题目内容
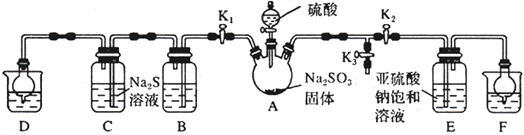
【题目】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图:

请根据以上信息回答下列问题:
Ⅰ.(1)写出N的化学式和B的名称:N________,B________。
(2)写出反应②的化学方程式,并标出其电子转移的方向和数目________________。
(3)写出反应③的离子方程式____________________________________。
Ⅱ.粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:①盐酸 ②氯化钡溶液 ③氢氧化钠溶液④碳酸钠溶液,以上试剂添加的顺序可以为________。
A.②③④① B.③④②①
C.④③②① D.③②④①
Ⅲ.提取粗盐后剩余的海水(母液)中,可用来提取Mg和Br2。
(1)若用来提取Mg,根据上述提取Mg的流程,没有涉及的反应类型是________。
A.分解反应 B.化合反应
C.置换反应 D.复分解反应
(2)若用来提取Br2,反应⑥所用的气态氧化剂的寻找货源的设想,其中合理的是_____。
A.从外地购买
B.在当地新建生产厂
C.从本厂生产烧碱处循环
D.从本厂生产镁单质处循环
流程⑦将溴单质从混合物中分离出来是基于溴单质具有________性。
(3)母液用来提取Mg和Br2先后顺序,甲乙两位工程师有不同观点:
甲:母液先提取Mg,后提取Br2
乙:母液先提取Br2,后提取Mg
请你判断哪个更合适?________(填“甲”或“乙”),理由是_________________。
【答案】HCl氢氧化钙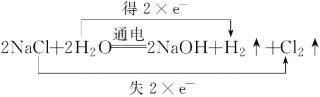 Cl2+2OH-=Cl-+ClO-+H2OADCCD挥发乙若先提取镁,海水中会残留大量Ca(OH)2,再用Cl2提取溴时会消耗大量Cl2(其他合理解释也可)
Cl2+2OH-=Cl-+ClO-+H2OADCCD挥发乙若先提取镁,海水中会残留大量Ca(OH)2,再用Cl2提取溴时会消耗大量Cl2(其他合理解释也可)
【解析】
根据流程图知:反应②为精盐溶液的电解,反应物是氯化钠和水,产物是氯气、氢气、氢氧化钠,C+F→N,N能溶解沉淀,C既能和F反应又能和E反应,所以E为NaOH,F为H2,C为Cl2,N为HCl,贝壳(主要成分为CaCO3)经过高温煅烧可以生成疏松的A为氧化钙,氧化钙可与水反应生成B为氢氧化钙,与母液反应生成氢氧化镁沉淀,氢氧化镁与盐酸反应生成氯化镁,电解熔融的氯化镁可生成氯气和镁,由转化关系可知D为Mg,以此解答该题。
根据以上分析为可知A为氧化钙,B为氢氧化钙,C为Cl2,D为Mg,E为NaOH,F为H2,则
Ⅰ.(1)根据以上分析为可知N的化学式为HCl,B的名称为氢氧化钙;
(2)惰性电极电解食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时生成氢氧化钠,生成1mol氢气转移2mol电子,则电子转移的方向和数目可表示为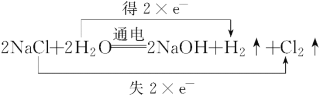 ;
;
(3)反应③是氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;
Ⅱ.Ca2+、Mg2+、SO42-等分别与Na2CO3溶液、NaOH溶液、BaCl2溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液还能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,试剂添加的顺序可以为②③④①或③②④①,答案选AD;
Ⅲ.(1)母液和B反应为海水中的镁离子和氢氧化钙反应生成氢氧化镁沉淀,为复分解反应,制取氯化氢为化合反应,氢氧化镁和盐酸反应得到氯化镁,为复分解反应,氯化镁电解为分解反应,该过程中未涉及的反应为置换反应,答案选C;
(2)提取Br2,反应⑥所用的气态氧化剂为氯气,本厂生产烧碱为电解氯化钠溶液,产物中有氯气,本厂生产镁单质,是电解无水氯化镁,电解氯化镁的产物为镁和氯气,故答案为CD;液溴易挥发,因此流程⑦将溴单质从混合物中分离出来是基于溴单质具有挥发性;
(3)母液用来提取Mg和Br2,若先提取镁,海水中会残留大量Ca(OH)2,Ca(OH)2能和氯气反应生成氯化钙、次氯酸钙和水,再用Cl2提取溴时会消耗大量Cl2,所以乙观点合理。