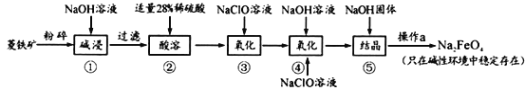
题目内容
【题目】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含Ce[ CO3]F)为原料制备CeO2的一种工艺流程如图所示:
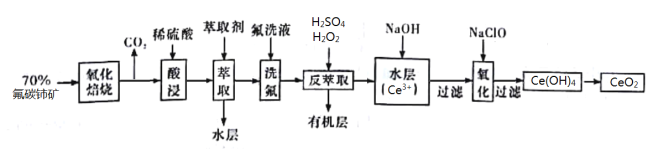
已知:①Ce4+能与F![]() 结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能;
③Ksp[Ce(OH)3]=1×10-20。
回答下列问题:
(1)Ce[CO3]F中铈元素的化合价为___________,H2O2分子的结构式为____________________。
(2)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是____________________________________。
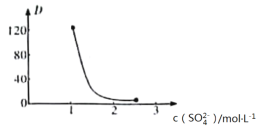
(3)“萃取”时存在反应:Ce4++n(HA)2![]() Ce·(H2n-4A2n)+4H+。下图所示中,D是分配比,表示Ce(Ⅳ)分别在有机层与水层中存在形式的物质的量浓度之比,即c[Ce·(H2n-4A2n)]与c[(CeSO4)2+]的比值。加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因为__________________________________________________。
Ce·(H2n-4A2n)+4H+。下图所示中,D是分配比,表示Ce(Ⅳ)分别在有机层与水层中存在形式的物质的量浓度之比,即c[Ce·(H2n-4A2n)]与c[(CeSO4)2+]的比值。加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因为__________________________________________________。
(4)“反萃取”中,实验室用到的主要玻璃仪器名称为___________;在H2SO4,和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作_________(填“催化剂”“氧化剂”或“还原剂”),每有2molH2O2参加反应,转移电子的物质的量为_____________。为使Ce3+完全沉淀,应加入NaOH调节pH为_________。(溶液中c(Ce3+)小于1.0×10-5molL-1时,可认为Ce3+沉淀完全)
(5)“氧化”步骤的化学方程式为_______________________________________________________。
【答案】+3 H-O-O-H 增大固体与气体的接触面积,增大反应速率,提高原料的利用率 随着c(SO42-)增大,水层中Ce4+与SO42-结合生成[CeSO4]2+,导致萃取平衡向生成(CeSO4)2+的方向移动,使D迅速减小,当c(SO42-)增大到一定程度后,D值变化较小 分液漏斗 还原剂 4 ≥9 2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl
【解析】
氟碳铈矿(主要含Ce[ CO3]F),氧化焙烧的目的是将+3价的Ce氧化为+4价,Ce4+能与F-结合生成[CeFx](4-x)+,以便后续的提取,加稀硫酸,与SO42-结合生成(CeSO4)2+,加萃取剂,氟洗液,硫酸体系中Ce4+能被萃取剂萃取,而Ce3+不能,加“反萃取剂”加H2O2,又将Ce4+还原为Ce3+,发生的离子反应为2Ce4++H2O2=2Ce3++O2↑+2H+,加入碱后Ce3+转化为沉淀,加NaClO将Ce从+3价氧化为+4价,最后热分解得到产物,由此进行分析作答。
(1)根据化合价代数和为零可知Ce的化合价为+3价;H2O2分子的结构式为H-O-O-H;
(2) “氧化焙烧”前需将矿石粉碎成细颗粒,其目的是增大固体与气体的接触面积,增大反应速率,提高原料的利用率;
(3)D随起始料液中c(SO42-)变化的原因为随着c(SO42-)增大,水层中Ce4+与SO42-结合生成(CeSO4)2+,导致萃取平衡向生成(CeSO4)2+的方向移动,使D迅速减小,当c(SO42-)增大到一定程度后,D值变化较小;
(4) “反萃取”中用到的玻璃仪器为分液漏斗;“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+,Ce从+4价降低到+3价,化合价降低,H2O2中O元素的化合价升高,因此H2O2在该反应中作还原剂;每有2molH2O2参加反应,转移电子的物质的量为2mol×2×(1-0)=4mol;当c(Ce3+)小于1.0×10-5molL-1时,可认为Ce3+沉淀完全,根据Ksp[Ce(OH)3]= c(Ce3+) c3(OH-)=1×10-20可知c(OH-)=![]() molL-1=1.0×10-5 molL-1,此时pH≥-lg
molL-1=1.0×10-5 molL-1,此时pH≥-lg![]() =9,即为使Ce3+完全沉淀,应加入NaOH调节pH为≥9;
=9,即为使Ce3+完全沉淀,应加入NaOH调节pH为≥9;
(5) “氧化”步骤中用NaClO将Ce3+氧化为Ce4+,反应方程式为:2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl。

 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案