题目内容
 600℃时,在一密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g)
600℃时,在一密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g)![]() 2SO3(g);△H<0。反应过程中SO2、O2、SO3物质的量变化如图,下列说法不正确的是( )
2SO3(g);△H<0。反应过程中SO2、O2、SO3物质的量变化如图,下列说法不正确的是( )
A. 反应从0 min开始,到第一次平衡时,二氧化硫的转化率 为40%
B. 反应进行到10min至15min的曲线变化可能升高了温度
C. 反应进行至20min时,曲线发生变化是因为通入了氧气
D. 在15-20min;25-30min内时反应处于平衡状态
AB

练习册系列答案
相关题目
 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2 (g)?2SO3(g) (△H<0)
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2 (g)?2SO3(g) (△H<0)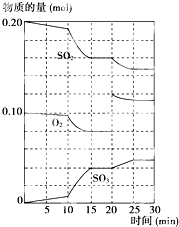 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示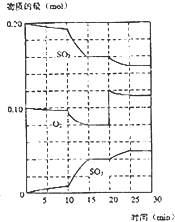 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0 2SO3(g)△H<0
2SO3(g)△H<0
