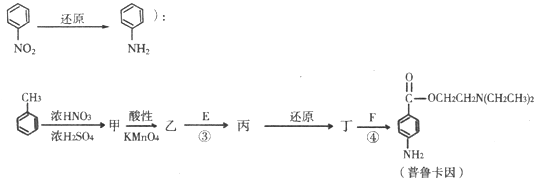
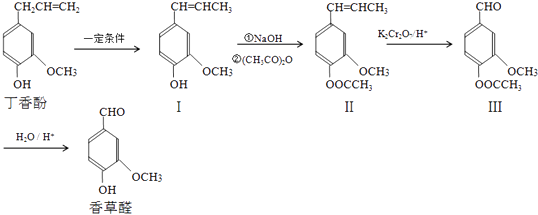
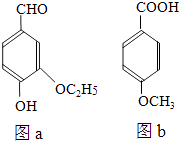
题目内容
【题目】冰醋酸加水溶解并不断稀释过程中,溶液导电能力与加入水的体积有如图变化关系: 
(1)“0”点导电能力为0的理由是:
(2)a、b、c三点中电离程度最大的是;电离平衡常数的关系是 . (填“逐渐增大”、“逐渐减小”或“不变”等)
(3)若要使c点溶液中c(CH3COO﹣)、c(H+)均增大,可采取的措施是(任填一种合理的措施即可)
【答案】
(1)冰醋酸中只存在醋酸分子,无自由移动的离子
(2)c;不变
(3)①加较活泼金属,如Na/Mg/Zn等,②加碱性氧化物或碱,如Na2O/NaOH等,③加某些弱酸的正盐或酸式盐,如Na2CO3/NaHCO3等
【解析】解:(1)电解质溶液是通过自有移动离子来导电,冰醋酸中只存在醋酸分子,无自由移动的离子,所以不导电,所以答案是:冰醋酸中只存在醋酸分子,无自由移动的离子;(2)溶液越稀,弱电解质的电离程度越大,根据图象知,加入的水越多,溶液越稀,则醋酸的电离程度越大,故选c,电离平衡常数与温度有关,温度不变电离平衡常数不变,
所以答案是:c;不变;(3)若使c点溶液中c(Ac﹣)、pH值均增大,可以加入和氢离子反应的物质,如①加较活泼金属,如Na/Mg/Zn等,生成氢气从而促进醋酸电离,②加碱性氧化物或碱,如Na2O/NaOH等,氢离子和碱或碱性氧化物反应生成水,从而促进醋酸电离;③加某些弱酸的正盐或酸式盐,如Na2CO3/NaHCO3等,氢离子和弱酸根离子反应从而促进醋酸电离,
所以答案是:①加较活泼金属,如Na/Mg/Zn等,②加碱性氧化物或碱,如Na2O/NaOH等③加某些弱酸的正盐或酸式盐,如Na2CO3/NaHCO3等.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案