题目内容
12.日常生活中我们经常用到一些消毒剂,下列有关说法正确的是( )| A. | 过氧化氢有“绿色氧化剂”之称,故过氧化氢只能作氧化剂 | |
| B. | 氯气常用于自来水的杀菌消毒,其中起杀菌消毒作用的是氯气 | |
| C. | 过氧乙酸(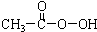 )分子中既有极性键又有非极性键 )分子中既有极性键又有非极性键 | |
| D. | 4.8g臭氧与3.36L氧气含有的原子总数相等 |
分析 A、过氧化氢中氧元素化合价为-1价,可以升高反应中做还原剂,也可以降低反应中做氧化剂;
B、氯气与水反应生成HClO,具有强氧化性;
C、C、H与C、O之间形成极性键,而C、C之间形成非极性键;
D、温度压强不知不能计算3.36L氧气物质的量.
解答 解:A、过氧化氢中氧元素化合价为-1价,可以升高为0价在反应中做还原剂,如和高锰酸钾溶液反应做还原剂,也可以降低为-2价,在反应中做氧化剂,如和亚铁离子的反应,故A错误;
B、氯气与水反应生成HClO,具有强氧化性,则氯气常用于自来水的杀菌消毒的物质是次氯酸,故B错误;
C、C、H与C、O之间形成极性键,而C、C之间形成非极性键,则分子中既有极性键又有非极性键,故C正确;
D、气体温度压强不知,3.36L氧气含有的原子总数不能计算,故D错误;
故选C.
点评 本题考查了氧化还原反应,化学键类型,气体摩尔体积的条件分析应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.稀硫酸中插一块铜片,加入少量下列物质并充分振荡后,铜可能没有发生反应的是( )
| A. | 硫酸铁晶体 | B. | 浓硝酸 | C. | 硝酸锌晶体 | D. | 浓硫酸 |
3.短周期元素X、Y可以形成化合物XY2.下列有关叙述正确的是( )
| A. | 若XY2是共价化合物,则X与Y的原子序数不可能相差1 | |
| B. | 若XY2是离子化合物,则X和Y的原子序数不可能相差8 | |
| C. | 若X与Y的原子序数相差5,则离子化合物XY2不溶于水 | |
| D. | 若X与Y的原子序数相差6,则共价化合物XY2不可溶于强碱溶液 |
20.下列叙述中正确的是( )
| A. | 液溴应保存于带磨口玻璃塞的广口试剂瓶中,并加水“水封”以减少其易挥发 | |
| B. | 向Ca(ClO)2溶液通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | |
| C. | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,原溶液中无NH4+ | |
| D. | 氨气是一种诚性气体,可用P2O5或无水CaCl2干燥 |
7.下列反应属于取代反应的是( )
①CH3CH2OH+HBr→CH3CH2Br+H2O
②CH4+2O2→CO2+2H2O
③CH3CH3+2Cl2$\stackrel{光照}{→}$CH2ClCH2Cl+2HCl
④ +HNO3$→_{55℃~60℃}^{浓H_{2}SO_{4}}$
+HNO3$→_{55℃~60℃}^{浓H_{2}SO_{4}}$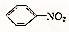 +H2O.
+H2O.
①CH3CH2OH+HBr→CH3CH2Br+H2O
②CH4+2O2→CO2+2H2O
③CH3CH3+2Cl2$\stackrel{光照}{→}$CH2ClCH2Cl+2HCl
④
 +HNO3$→_{55℃~60℃}^{浓H_{2}SO_{4}}$
+HNO3$→_{55℃~60℃}^{浓H_{2}SO_{4}}$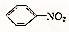 +H2O.
+H2O.| A. | 仅③ | B. | 仅①③ | C. | 仅①③④ | D. | 全部 |
1.下列推断正确的是( )
| A. | Na2O、Na2O2组成元素虽然相同,但与H2O、CO2等反应的产物不完全相同 | |
| B. | SiO2 是酸性氧化物,不溶于水,也不能与任何酸发生反应 | |
| C. | CO、SO2、NO、NO2都是对大气产生污染的气体,他们在空气中都能稳定存在 | |
| D. | 浓硫酸可用于干燥氢气、氯化氢、碘化氢等气体,但不能干燥氨气、二氧化氮气体 |
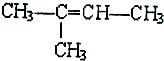 的名称是2-甲基-2-丁烯:
的名称是2-甲基-2-丁烯: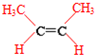 :
: ;
;