题目内容
硫化氢(H2S)是一种有毒的可燃性气体,用H2S、空气和KOH溶液可以组成燃料电池,其总反应式为2H2S+3O2+4KOH=2K2SO3+4H2O。
(1)该电池工作时正极应通入 。
(2)该电池的负极电极反应式为: 。
(3)该电池工作时负极区溶液的pH (填“升高”“不变”“降低”)
(4)有人提出K2SO3可被氧化为K2SO4,因此上述电极反应式中的K2SO3应为K2SO4,某学习小组欲将电池工作一段时间后的电解质溶液取出检验,以确定电池工作时反应的产物。实验室有下列试剂供选用,请帮助该小组完成实验方案设计。
0.01mol·L-1KMnO4酸性溶液,1mol·L-1HNO3,1mol·L-1H2SO4,1mol·L-1HCl,
0.1mol·L-1Ba(OH)2,0.1 mol·L-1 BaCl2。
|
|
实验步骤 |
实验现象及相关结论 |
|
① |
取少量电解质溶液于试管中,用pH试纸测其pH。 |
试纸呈深蓝色,经比对溶液的pH约为14,说明溶液中有残余的KOH。 |
|
② |
继续加入 溶液,再加入 溶液,振荡。 |
若有白色沉淀产生,则溶液中含有K2SO4。 若无白色沉淀产生,则溶液中没有K2SO4。 |
|
③ |
另取少量电解质溶液于试管中,先加 1 mol·L-1的H2SO4酸化,再滴入2~3滴0.01 mol·L-1KMnO4酸性溶液,振荡。 |
;
。 |
(5)若电池开始工作时每100mL电解质溶液含KOH56g,取电池工作一段时间后的电解质溶液20.00mL,加入BaCl2溶液至沉淀完全,过滤洗涤沉淀,将沉沉在空气中充分加热至恒重,测得固体质量为11.65g,计算电池工作一段时间后溶液中KOH的物质的量浓度 。 (结果保留四位有效数字,假设溶液体积保持不变,已知:M(KOH)=56,M(BaSO4)=233,M(BaSO3)=217)
(12分)(1)空气(或氧气) (1分)
(2)2H2S+16OH-—12e-=2SO32-+10H2O 或H2S+8OH-—6e-=SO32-+5H2O(3分)
(3)降低(1分)
(4)①足量1mol·L-1 HCl (1分) 少量0.1 mol·L-1 BaCl2 (1分)
②若KMnO4溶液紫红色褪去,则说明溶液中含有K2SO3,若KMnO4溶液紫红色不褪,则说明溶液不含K2SO3(2分)。
(5)5.000 mol·L-1(3分)
【由于BaSO3在空气中加热时转化为BaSO4,
n(BaSO4)=11.65g/233g•mol-1=0.05000mol,即n(K2SO4)+n(K2SO3)=0.05000mol
反应后溶液中: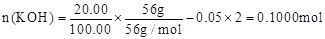
 (其它合理解法也给分)】
(其它合理解法也给分)】
【解析】(1)正极发生还原反应,正极主要反应物所含元素化合价一定降低,总反应中氧元素由0价降为—2价,硫元素由—2价升为+4价,则放电时正极应通入氧气,负极应通入硫化氢;(2)负极主要反应物→产物是H2S→SO32-;根据化合价升高总数等于失去电子数,则H2S—6e-→SO32-;左右电荷数分别为+6、—2,根据KOH溶液显强碱性及电荷守恒,则H2S—6e-+8OH-→SO32-;根据左右氢或氧原子守恒,则负极反应式为H2S+8OH-—6e-=SO32-+5H2O或2H2S+16OH-—12e-=2SO32-+10H2O;(3)放电时负极消耗OH-,负极区溶液的碱性减弱,因此溶液pH降低;(4)K2SO3、K2SO4都能与Ba(OH)2、BaCl2反应生成白色沉淀,因此检验K2SO4的存在时要排除K2SO3的干扰;K2SO3与HCl易反应,Ba(OH)2的成本较高,因此步骤②中应继续加入足量1mol·L-1HCl,充分反应后再加入几滴0.1 mol·L-1 BaCl2,若有白色沉淀产生,则溶液中含有K2SO4;若无白色沉淀产生,则溶液中没有K2SO4;步骤③的目的是检验K2SO3的存在,先加适量硫酸中和KOH至溶液呈酸性,然后加入适量酸性高锰酸钾溶液,利用K2SO3能使酸性高锰酸钾溶液褪色的性质,如果没有K2SO3,酸性高锰酸钾溶液不褪色;如果褪色,说明存在K2SO3;(5)K2SO3+BaCl2=BaSO3↓+2KCl,K2SO4+BaCl2=BaSO4↓+2KCl,2BaSO3+O2=2BaSO4,则最后所得固体为硫酸钡;n(BaSO4)=11.65g÷233g/mol=0.05000mol,则20mL电解质溶液中n(K2SO3)+n(K2SO4)=0.05000mol,故100mL电解质溶液中n(K2SO3)+n(K2SO4)=0.2500mol;根据硫守恒可知,n(H2S) =0.2500mol;2H2S+3O2+4KOH=2K2SO3+4H2O,根据系数之比等于物质的量之比,则n(KOH) =0.5000mol;电池工作前,n(KOH) =56g÷56g/mol=1.000mol,则电解工作一段时间后剩余的n(KOH)=(1.000—0.5000)mol=0.5000mol,则100mL电解质溶液中c(KOH)=0.500mol÷0.1L=5mol/L。
考点:考查燃料电池的工作原理及探究实验、实验方案的设计,主要包括燃料电池两极通入物质的辨别、书写负极反应式、判断负极附近溶液pH的变化、设计实验方案检验燃料电池工作一段时间后电解质的成分、计算电解质溶液中某物质的浓度等。

 ),有关反应如下:
),有关反应如下: