题目内容
【题目】氮化锶(Sr3N2)在工业上有广泛应用。已知氮化锶遇水剧烈反应产生氢氧化锶和氨气。
锶和镁位于同主族且锶比镁活泼, 锶与氮气在加热条件下反应产生氮化锶。某学习小组拟设计两套方案制备氮化锶:
方案Ⅰ:根据下列装置制备氮化锶。
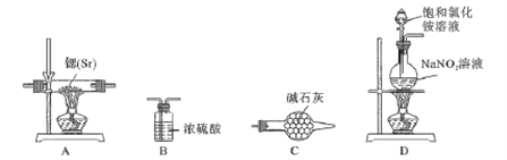
已知:实验室用饱和氯化铵溶液和亚硝酸钠溶液共热制备氮气。
回答下列问题:
(1)气流从左至右,选择装置并排序为___________(填字母表示)。
(2)写出实验室制备N2的化学方程式____________
(3)实验时先点燃_____处酒精灯(填“A”或“D”),一段时间后,点燃另一只酒精灯。
(4)氮化锶遇水发生反应的化学方程式为____________
方案Ⅱ:某氮气样品可能含有少量的CO、CO2、O2等气体杂质,某同学设计如下装置制备氮化锶(各装置盛装足量试剂)。已知:醋酸二氨合亚铜CH3COO[Cu(NH3)2]溶液能定量吸收CO,但易被O2氧化,失去吸牧CO能力;连苯三酚鹹性溶液能定量吸收O2.
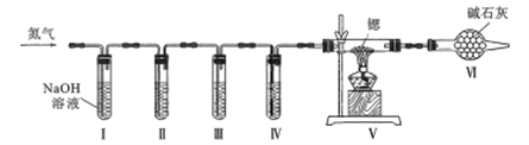
(5)试管Ⅱ盛装的试剂是__________填代号)。
a.连苯三酚碱性溶液b.醋酸二氨合亚铜溶液 C.浓巯酸d.赤热铜粉
装置Ⅵ的作用是_______________
(6)测定产品纯度:取wg产品,向其中加入适量的水。将产生的气体全部通人到依硫酸中,依硫酸增重mg,则产品纯度为__(用代数式表示)。有同学认为上述方法使测得产品纯度偏高,其原因是___________
【答案】 D、B、A、C NH4Cl+NaNO2![]() NaCl+N2↑+2H2O D Sr3N2+6H2O=3Sr(OH)3+2NH3↑ a 吸收空气中CO和H2O(g) 146m/(17w)×100% 氨气中混有水蒸气
NaCl+N2↑+2H2O D Sr3N2+6H2O=3Sr(OH)3+2NH3↑ a 吸收空气中CO和H2O(g) 146m/(17w)×100% 氨气中混有水蒸气
【解析】(1)气流从左至右,先制取氮气,再用浓硫酸干燥,与锶反应,用碱石灰防止空气中水和二氧化碳气体进入A中,选择装置并排序为 D、B、A、C 。(2)实验室用饱和氯化铵溶液和亚硝酸钠溶液共热制备氮气,实验室制备N2的化学方程式 NH4Cl+NaNO2![]() NaCl+N2↑+2H2O;(3)实验时先点燃D处酒精灯(填“A”或“D”),赶走装置中的空气,一段时间后,点燃另一只酒精灯。(4)氮化锶遇水发生反应的化学方程式为 Sr3N2+6H2O=3Sr(OH)3+2NH3↑。
NaCl+N2↑+2H2O;(3)实验时先点燃D处酒精灯(填“A”或“D”),赶走装置中的空气,一段时间后,点燃另一只酒精灯。(4)氮化锶遇水发生反应的化学方程式为 Sr3N2+6H2O=3Sr(OH)3+2NH3↑。
方案Ⅱ:某氮气样品可能含有少量的CO、CO2、O2等气体杂质,某同学设计如下装置制备氮化锶(各装置盛装足量试剂)。I用碱吸收二氧化碳,试管Ⅱ用连苯三酚鹹性溶液能定量吸收O2,Ⅲ中醋酸二氨合亚铜CH3COO[Cu(NH3)2]溶液能定量吸收CO;(5)试管Ⅱ盛装的试剂是a,吸收氧气。装置Ⅵ的作用是吸收空气中CO和H2O(g);(6)测定产品纯度:取wg产品,向其中加入适量的水。将产生的气体全部通人到依硫酸中,依硫酸增重mg,
2NH3~~~Sr3N2
34 292
mg x
x=146m/17g,则产品纯度为146m/(17w)×100%。有同学认为上述方法使测得产品纯度偏高,其原因是 氨气中混有水蒸气。

【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)请写出H2SO3的电离平衡常数K1的表达式:________________。
(2) 常温下,将体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
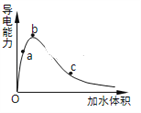
(3)一定条件下,冰醋酸加水稀释过程中溶液导电能力I随加水体积V变化曲线如右图所示,则a、b、c三点溶液醋酸的电离程度由大到小为____________________。
(4)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为___________。
(5)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为________________。