��Ŀ����
����Ŀ���Ȼ�����Ʒ�к�������̼��ء�����غͲ�����ˮ�����ʣ�Ϊ���ᴿ�Ȼ��أ��Ƚ���Ʒ��������ˮ�У���ֽ������ˣ��ڽ���Һ��ͼ��ʾ������в�����
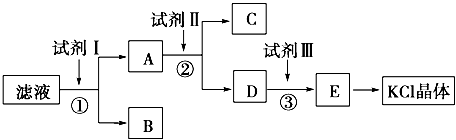
�ش��������⣺
��1��Ϊ������ʼ��Һ�е�Cl���������Լ�����ϡHNO3,����Ҫ ��
��2���Լ�I�Ļ�ѧʽΪ ���ж��Լ�I�Ѽӹ����ķ��� ��
��3���Լ���Ļ�ѧʽΪ ���м����Լ����Ŀ���� ��
��4���Լ���������� ���з�����Ӧ�����ӷ���ʽΪ ��
��5��ijͬѧ������������KCl����������ԭ��Ʒ����������Ȼ�����Ʒ�Ĵ��ȣ�����Ϊ����ɿ��𣿲�˵��������������ʵ�������
���𰸡�
��1��Ba��NO3��2��AgNO3��ֻ��AgNO3��������
��2��BaCl2��ȡ������ҺA�����Լ�����������������ѹ���
��3��K2CO3����ȥǰ������Ĺ�����Ba2+
��4��������CO32-+2H+=CO2��+H2O
��5�����ɿ�������KCl���岢����ȫ����ԭ��Ʒ
��������
�������:��1�� �Ȼ�����Ʒ�к�������̼��ء�����أ�������Һ�е�����������������Һ����̼������������Ҳ�ǰ�ɫ���������Լ���Cl��֮ǰ��������ᱵ��Һ��ȥ̼������Ӻ���������ӣ��������Լ�����ϡHNO3�⣬����ҪBa��NO3��2 ��AgNO3��Һ��
��2��Ҫ�������������������̼�����Ӧ����������Ȼ�����Һ��̼�������������ɲ�����ˮ�ı��Σ�ͬʱ�����Ȼ��أ������Լ���ΪBaCl2��Һ���ж��Լ�I�Ѽӹ����ķ�����ȡ������ҺA�����Լ�����������������ѹ�����
��3��Ҫ��������ı����ӣ�Ҫ����̼��أ�̼��غ��Ȼ�����Ӧ����̼�ᱵ����ͬʱ�����Ȼ��أ������Լ���Ļ�ѧʽΪK2CO3�����м����Լ����Ŀ���dz�ȥǰ������Ĺ�����Ba2+��
��4��Ҫ���������̼�����Ҫ�μ����������ᣬ̼������Ӻ����ᷴӦ���ɶ�����̼��ˮ�������Լ�������������ᣬ���з�����Ӧ�����ӷ���ʽΪCO32-+2H+= CO2��+H2O��
��5����Ϊ����KCl���岢����ȫ����ԭ��Ʒ�����Ը�����������KCl����������ԭ��Ʒ����������Ȼ�����Ʒ�Ĵ��Ȳ��ɿ���

����Ŀ�����ἰ�����ڹ�ũҵ������������Ҫ��Ӧ�á�
��1��SO2������ΪSO3�ķ�Ӧ�ǹ�ҵ���������Ҫ���̣�����ͼ�Ƿ�Ӧ������SO2��SO3��Ũ���Sʱ��t�ı仯�������Ӧ�ӿ�ʼ���ﵽƽ��ʱ����O2��ʾ��ƽ����Ӧ����Ϊ ��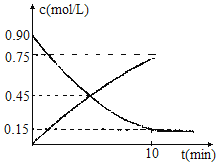
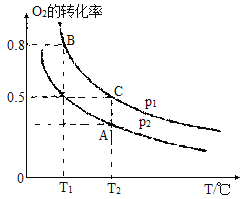
����һ�ݻ��ɱ���ܱ������г���һ����SO2(g)��O2(g)��O2��ƽ��ת������ͼ��ʾ����p1��p2�Ĵ�С��ϵ��p1 p2 ����������������������������A��B��C�����ƽ�ⳣ����С��ϵΪ ����Ka��Kb��Kc��ʾ�����Ӧ��ƽ�ⳣ������
��2��������������в�����β�������ð�ˮ���գ���Һ������(NH4)2SO4��(NH4)2SO3�����ʡ�
��(NH4)2SO4��Һ�����Ե�ԭ���� �������ӷ���ʽ��ʾ����
����֪��
NH3��H2O | H2SO3 | |
����ƽ�ⳣ�� | 1.7��10��5 | Ka1��1.54��10��2 Ka2��1.02��10��7 |
NH4HSO3��Һ�� ������������������������������������
��25��ʱ����ͬ���ʵ�����SO2��NH3����ˮ��������Һ��c(H+)��c(OH��)�� �����������
A��c(SO32��)��c(H2SO3)
B��c(HSO3��)+c(SO32��)��c(NH4+)
C��c(SO32��)+c(NH3��H2O)��c(H2SO3)
D��(HSO3��)+2c(SO32��)��c(NH4+)
��3����֪����BaSO4(s)+4C(s)��BaS(s)+4CO(g) ��H��+571.2kJmo1��1
��BaS(s)��Ba(s)+S(s) ��H��+460kJmo1��1
��2C(s)+O2(g)��2CO(g) ��H����221kJmo1��1
����Ba(s)��S(s)��O2(g)��Ӧ����BaSO4(s)���Ȼ�ѧ����ʽΪ ��
