题目内容
位于周期表第3、4周期的主族元素A和B,它们的离子相差两个电子层。已知A元素位于元素周期表中第m主族,B元素位于第n主族,那么:
(1)A元素原子的核外电子数为(用含m的代数式表示)______________________。
(2)B元素原子的核内质子数为(用含n的代数式表示)____________________,其离子的电子数为_____________________。
(3)A、B两元素形成的化合物化学式为AB2,其化学键类型为___________________。
(4)用电子式表示AB2的形成过程____________________________。
(1)10+m (2)28+n 36 (3)离子键
(4)![]()
解析:
(1)对于第3周期第m主族的金属元素A来讲,其原子的核外电子数为10+m。
(2)处于第4周期第n主族的非金属元素B,其原子的核外电子层排布为![]() ,形成离子的核外电子层排布为
,形成离子的核外电子层排布为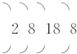 。
。
(3)由A、B元素形成化合物的化学式AB2并结合以上推理,可知A为+2价的Mg,B为-1价的Br,它们形成的化合物MgBr2为离子化合物。

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
 或
或
 (2013?德州一模)【化学一物质结构与性质】
(2013?德州一模)【化学一物质结构与性质】

