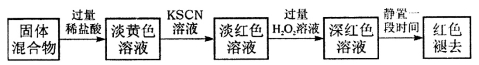
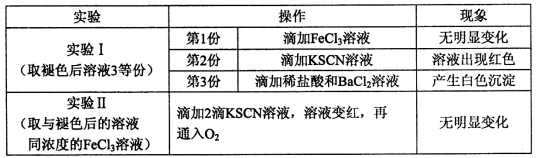
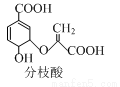
题目内容
下列说法中正确的是( )
A.在25℃的某溶液中,若c(H+)=c(OH-)=10-7 mol/L,则溶液呈中性
B.溶液中若c(H+)>10-7 mol/L,则c(H+)>c(OH-),溶液显酸性
C.c(H+)越大,则pH值越大,溶液的酸性越强
D.pH值为0的溶液中c(H+) = 0 mol/L
练习册系列答案
相关题目
用下列试剂和试管中的物质不能完成相应实验目的的是
实验目的 | 试剂 | 试管中的物质 |
| |
A | 苯环对甲基的影响 | 酸性KMnO4溶液 | ①苯②甲苯 | |
B | 比较Br—、Fe2+和I—的还原性 | 氯水 | ①FeBr2溶液②FeI2溶液 | |
C | 苯分子中没有碳碳双键 | Br2的CCl4溶液 | ①苯②己烯 | |
D | 探究接触面积对反应速率的影响 | VmL、cmol/L的盐酸 | ①ag大理石块②ag大理石粉 |




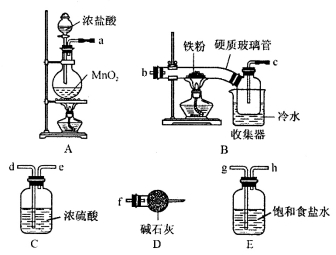
 水氯化铁在空气中易潮解,加热易升华;②工业上,向500—600℃的铁屑中通入氯气可生产无水氯化铁;③向炽热铁屑中通入氯化氢可以生产无水氯化亚铁和氢气。
水氯化铁在空气中易潮解,加热易升华;②工业上,向500—600℃的铁屑中通入氯气可生产无水氯化铁;③向炽热铁屑中通入氯化氢可以生产无水氯化亚铁和氢气。