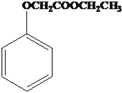
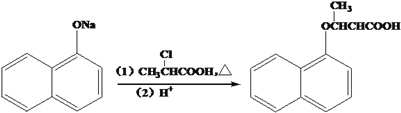题目内容
【题目】在浓硝酸中放入铜片发生反应:
(1)待反应停止后,若铜有剩余,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,原因是(用离子方程式表示)
(2)若将12.8g铜跟一定量的浓硝酸反应,铜耗完时,共产生气体5.6L(标况).则所消耗硝酸的物质的量是 mol
(3)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2 , 使其充分反应,若要使水恰好充满容器,理论上需要参加反应的O2的物质的量是 mol.
【答案】
(1)3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O
(2)0.65
(3)0.1
【解析】解:(1.)酸性条件下,硝酸根离子具有强氧化性,能氧化Cu生成铜离子,自身被还原生成NO,离子方程式为3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O,所以答案是:3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O;
(2.)n(Cu)= ![]() =0.2mol,Cu生成Cu(NO3)2 , 同时生成氮氧化物NOx , n(NOx)=
=0.2mol,Cu生成Cu(NO3)2 , 同时生成氮氧化物NOx , n(NOx)= ![]() =0.25mol,根据N原子守恒得消耗n(HNO3)=2n[Cu(NO3)2]+n(NOx)=2×0.2mol+0.25mol=0.65mol,所以答案是:0.65;
=0.25mol,根据N原子守恒得消耗n(HNO3)=2n[Cu(NO3)2]+n(NOx)=2×0.2mol+0.25mol=0.65mol,所以答案是:0.65;
(3.)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2 , 使其充分反应,该反应中氧气得电子和氮氧化物转化为硝酸,根据转移电子守恒知,Cu失去电子数等于氧气得到电子数,所以消耗氧气物质的量= ![]() =0.1mol,所以答案是:0.1.
=0.1mol,所以答案是:0.1.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目