题目内容
【题目】表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题: 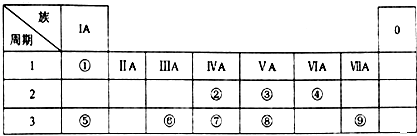
(1)⑨的原子结构示意图为 .
(2)②的气态氢化物分子的结构式为⑧的最高价氧化物的水化物的分子式 .
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是 . (填化学式)
(4)⑤、⑥元素的金属性强弱依次 . (填“增大”、“减小”或“不变”)
(5)④、⑤、⑥形成的简单离子半径依次 . (填“增大”、“减小”或“不变”)
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式 .
(7)⑤、⑥、⑨的最高价氧化物对应水化物两两均能反应,写出其反应的离子方程式.、、 .
【答案】
(1)![]()
(2)![]() ;H3PO4
;H3PO4
(3)HNO3>H2CO3
(4)减小
(5)减小
(6)![]()
(7)Al(OH)3+OH﹣=AlO2﹣+2H2O;H++OH﹣=H2O;Al(OH)3+3H+=Al3++3H2O
【解析】解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为P、⑨为 Cl.
(1.)⑨为 Cl,原子核外电子数为17,各层电子数为2、8、7,原子结构示意图为: ![]() ,所以答案是:
,所以答案是: ![]() ;
;
(2.)②为C,气态氢化物为CH4 , 结构式为 ![]() ,⑧为P,最高价氧化物的水化物的分子式为H3PO4 , 所以答案是:
,⑧为P,最高价氧化物的水化物的分子式为H3PO4 , 所以答案是: ![]() ;H3PO4;
;H3PO4;
(3.)②、③分别为C、N,非金属性N>C,故最高价氧化物对应水化物的酸性HNO3>H2CO3 , 所以答案是:HNO3>H2CO3;
(4.)⑤、⑥元素分别为Na、Al,同周期从左到右金属性减弱,金属性钠大于铝,所以答案是:减小;
(5.)电子层数越多,半径越大,相同电子层数,原子序数越小半径越大,④、⑤、⑥形成的简单离子分别为O2﹣、Na+、Al3+ , 半径依次减小,所以答案是:减小;
(6.)H、O、Na元素可形成既含离子键又含共价键的化合物为氢氧化钠,电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(7)⑤、⑥、⑨的最高价氧化物对应水化物分别为氢氧化钠、氢氧化铝、高氯酸,两两反应离子方程式分别为Al(OH)3+OH﹣=AlO2﹣+2H2O,H++OH﹣=H2O,Al(OH)3+3H+=Al3++3H2O,所以答案是:Al(OH)3+OH﹣=AlO2﹣+2H2O;H++OH﹣=H2O;Al(OH)3+3H+=Al3++3H2O.
;(7)⑤、⑥、⑨的最高价氧化物对应水化物分别为氢氧化钠、氢氧化铝、高氯酸,两两反应离子方程式分别为Al(OH)3+OH﹣=AlO2﹣+2H2O,H++OH﹣=H2O,Al(OH)3+3H+=Al3++3H2O,所以答案是:Al(OH)3+OH﹣=AlO2﹣+2H2O;H++OH﹣=H2O;Al(OH)3+3H+=Al3++3H2O.

【题目】一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6 min的平均反应速率: v(H2O2)≈3.3×10-2mol·L-1·min-1
B. 0~6 min的平均反应速率: v(H2O2)<3.3×10-2mol·L-1·min-1
C. 反应至6 min时,c(H2O2)=0.30 mol/L
D. 反应至6 min时,H2O2分解了50%
【题目】甲醇是重要的化工原料,又可作为燃料。一氧化碳与氢气可以合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
(1)若该反应在恒温恒容条件下进行,下列说法正确的是_________;
a.若混合气体的平均摩尔质量不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入氩气使压强增大,平衡向右移动,CO转化率增大
c.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
d.若使用催化剂,会改变反应的途径,反应的焓变减小
(2)某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数K=50 ![]() ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:
物质 | CO | H2 | CH3OH |
物质的量/mol | 0.4 | 0.4 | 0.8 |
请比较此时正、逆反应速率的大小:v正 ____v逆(填“>”、“<”或“=”)
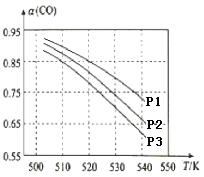
(3)CO平衡转化率(α)与温度和压强的关系如图所示。CO平衡转化率[α(CO)] 随温度升高而______(填“增大”或“减小”),其原因是_______。图中的压强由大到小的顺序为________,其判断理由是________。
(4)在直接以甲醇为燃料的燃料电池中,若电解质溶液为酸性,则,负极的反应式为_______________________,正极的反应式为________________________。
