题目内容
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为________。
(2)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液的pH与NaOH客液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式:________。
②b点时溶液中c(H2N2O2)________c(N2O22-)。(填“>”“<”或“=”下同)
③a点时溶液中c(Na+)________c(HN2O2-)+c(N2O22-)。
【答案】 +1 H2N2O2![]() H++HN2O2-, HN2O2-
H++HN2O2-, HN2O2-![]() H++N2O22- > >
H++N2O22- > >
【解析】(1)H2N2O2分子中H的化合价为+1,O元素的化合价为-2,设N元素的化合价为x,根据总化合价之和为0可知:2x+(+1)×2+(-2)×2=0,解得:x=1,即N元素的化合价为+1,故答案为:+1;
(2)①根据图像可知,氢氧化钠溶液体积为0时,0.01mol/L的H2N2O2溶液的pH=4.3,说明H2N2O2为二元弱酸,二元弱酸以第一步电离为主,则其电离方程式为:H2N2O2![]() HN2O2-+H+,HN2O2-
HN2O2-+H+,HN2O2- ![]() H++N2O22-,故答案为:H2N2O2
H++N2O22-,故答案为:H2N2O2![]() HN2O2-+H+,HN2O2-
HN2O2-+H+,HN2O2- ![]() H++N2O22-;
H++N2O22-;
②b点溶质为NaHN2O2,溶液的pH>7,说明溶液显示碱性,则HN2O2-的水解程度大于其电离程度,所以c(H2N2O2)>c(N2O22-),故答案为:>;
③根据图像可知,a点时溶液的pH=7,溶液呈中性,则c(OH-)=c(H+),根据电荷守恒可知c(Na+)=c(HN2O2-)+2c(N2O22-),所以c(Na+)>c(HN2O2-)+c(N2O22-),故答案为:>。

【题目】某科技小组利用NaClO, NaClO2复合吸收剂研究烟气脱硫脱硝技术.
(1)随着pH值的增大,烟气脱硫和脱硝效率均呈下降趋势,可能的原因是_________。
(2)若其他条件不变,改变脱硫脱硝温度对脱除效率的影响如下图所示:
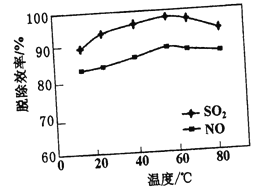
随着温度的升高,脱硫和脱硝的效率先缓慢增加,后逐渐下降,分析可能原因有____、_____。
(3)在脱硫脱硝过程中存在ClO2、ClO2-和ClO3-,它们的含量可采用连续碘量滴定法测定。已知:碘量法的瘾定反应为I2+2S2O32-=2I-+S4O62-。
实验方法:取VmL试样,控制溶液pH,加入20%的碘化钾溶液4mL,暗处放置5分钟后,用0.01mol/LNa2S2O3溶液滴定,淀粉作指示剂,记录消耗Na2S2O3溶液体积。三次实验的溶液pH、反应及消耗Na2S2O3溶液的体积见下表:
实验 | pH | 反应 | Na2S2O3溶液体积/mL |
① | pH=7.0 | 2C1O2+2I-=I2+2ClO2- | V1 |
② | pH=4.0 | ClO2-+4I-+4H+=2I2+Cl-+2H2O | V2 |
③ | pH<0.1 | ClO3-+6I-+6H+=3I2+Cl-+3H2O 2ClO2+10I-+8H+=5I2+2Cl-+4H2O ClO2-+4I-+4H+=2I2+Cl-+2H2O | V3 |
注:实验②控制pH前先鼓入氮气以除去ClO2。
计算试样中ClO3-的浓度为多少mg/L(写出计算过程,用含V1、V2、V3、V的代数式表示)_____.
