题目内容
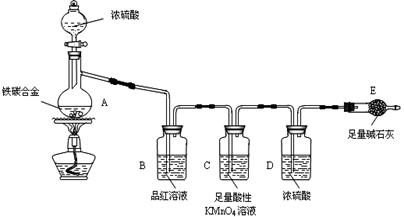
某实验小组设计了下列装置进行氨的催化氧化实验。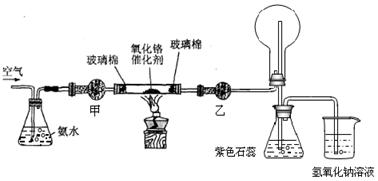
完成下列填空:
(1)常温下,氨水的浓度为1:1.5(28%的浓氨水和水的体积比)时实验现象明显,配制该浓度氨水的玻璃仪器有 。
(2)本实验用的干燥剂是碱石灰和无水氯化钙。则甲处是____________;乙处是___________。
(3)实验时,先将催化剂加热至红热,在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明反应是_____(填“吸”或“放”)热反应;化学方程式为 。
(4)实验前,烧杯中盛有200mL 1.000 mol/L的 NaOH溶液,实验后测得烧杯中溶液的pH=13,且溶液质量比反应前增加了7.48g,则NaOH溶液吸收的NO和NO2的物质的量之比
是 (设溶液的体积不变且忽略盐类的水解)。
(5)实验时发现:如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中产生白烟。其原因可用化学方程式表示为: 、 。
(6)已知NH3和N2常压下的沸点分别为:-33.5℃和-195.8℃,据此推测这两种物质中,能做制冷剂的是 (填分子式);能用来冷冻物质的是 (填分子式)。
(1)量筒、烧杯、玻璃棒 (2分,缺一项得1分)
(2)甲处:碱石灰;(1分)乙处:无水氯化钙(1分)
(3)放热反应(1分); 4NH3+5O2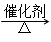 4NO+6H2O(1分)
4NO+6H2O(1分)
(4) 5:13(2分)
(5)4NO+3O2+2H2O→4HNO3(1分,或2NO+O2→2NO2和3NO2+H2O→2HNO3+ NO
或4NO2+O2+2H2O→4HNO3也给分);NH3+HNO3→NH4NO3(1分)
(6)NH3(1分);N2(1分)
解析试题分析:
(1)氨水的浓度为1:1.5,是体积比浓度,可以量取溶液体积混合得到,利用量筒量取氨水和水在烧杯中混合后,用玻璃棒搅拌得到配制的溶液;故答案为:量筒、烧杯、玻璃棒;
(2)甲处是干燥氨气需要用碱石灰,防止水蒸气进入玻璃管炸裂玻璃管,乙处是干燥一氧化氮气体用氯化钙,不吸收后再后续装置会生成白烟;氨气不能用氯化钙干燥;甲处:碱石灰;乙处:无水氯化钙;故答案为:碱石灰,氯化钙;
(3)实验时,先将催化剂加热至红热,在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,反应是放热反应,发生的是氨气的催化氧化反应生成一氧化氮和水,反应的化学方程式为:4NH3+5O2==4NO+6H2O故答案为:放热反应; 4NH3+5O2==4NO+6H2O;
(4)实验前,烧杯中盛有200mL 1.000mol/L的 NaOH溶液,实验后测得烧杯中溶液的pH=13,氢氧根离子浓度为0.1mol/L,且溶液质量比反应前增加了7.48g为一氧化氮和二氧化氮 气体质量,消耗氢氧化钠物质的量=0.2L×1mol/L-0.1mol/L×0.2L=0.18mol;设NO物质的量为x,NO2物质的量为y,得到: x+y=0.18 ; 28x+46y=7.48,解得x=0.05mol,y=0.13mol,NO和NO2的物质的量之比=0.05:0.13=5:13;故答案为:5:13;
(5)如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中产生白烟,氨气被氧化生成一氧化氮,一氧化氮和空气中的氧气反应生成二氧化氮,通入水中反应生成硝酸,硝酸和过量的氨气反应生成硝酸铵固体小颗粒,冒白烟;反应的很幸福陈楚生为:4NO+3O2+2H2O=4HNO3,或2NO+O2=2NO2和3NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3;NH3+HNO3=NH4NO3;故答案为:4NO+3O2+2H2O→4HNO3,或2NO+O2→2NO2和3NO2+H2O→2HNO3+NO;或4NO2+O2+2H2O→4HNO3;NH3+HNO3→NH4NO3;
(6)沸点低的易气化吸收热量,可以做制冷剂,冷冻物质沸点高的液化后可以做冷冻物质的物质,已知NH3和N2常压下的沸点分别为:-33.5℃和-195.8℃,据此推测这两种物质中,能做制冷剂的是氨气;能用来冷冻物质的是氮气;故答案为:NH3;N2;
考点:考查:本题考查了氨气实验室制备,性质验证方法,氨气的催化氧化反应,气体干燥试剂选择,产物吸收,过程反应化学方程式的书写,题目难度中等.

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
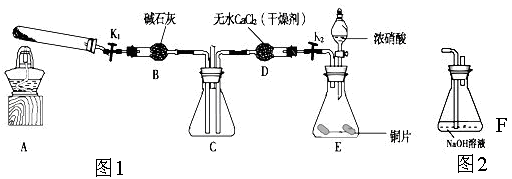
金牌教辅培优优选卷期末冲刺100分系列答案某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。
(1)A中制取Cl2的离子方
程式__________________
(2)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中只含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和_____________________________;
假设2:存在三种成分:NaHCO3和_____________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2: 向A试管中滴加BaCl2溶液 | |
| 步骤3: | |
(3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为____________________________。
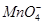 +□H2O=□
+□H2O=□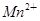 +□
+□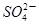 +□H+;
+□H+;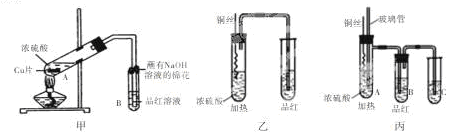


 ,下列说法不正确是
,下列说法不正确是