题目内容
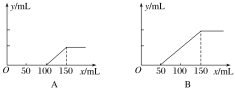
【题目】将一定质量的镁和铝混合物投入200 mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示。则下列说法不正确的是( )
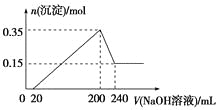
A.镁和铝的总质量为9 g
B.合金与稀硫酸反应生成的氢气体积为10.08 L
C.稀硫酸的物质的量浓度为2.5 mol/L
D.氢氧化钠溶液的物质的量浓度为5 mol/L
【答案】B
【解析】
由图像可知:将一定质量的镁和铝混合物投入200 mL稀硫酸中,固体全部溶解后,所得溶液为H2SO4、Al2(SO4)3、MgSO4的混合溶液。发生的有关化学反应方程式为:2Al+3H2SO4= Al2(SO4)3+ 3H2↑;Mg+ H2SO4= MgSO4+H2↑;H2SO4+2NaOH=Na2SO4+H2O。Al2(SO4)3+6NaOH= 3Na2SO4+ 2Al(OH)3↓;MgSO4+2NaOH= Na2SO4+Mg(OH)2↓; Al(OH)3+NaOH= NaAlO2 + 2H2O。
A.n[Al(OH)3] =(0.35-0.15)mol=0.2mol;n[Mg(OH)2]=0.15mol。m(合金)=m(Al)+m(Mg)= 0.2mol×27g/mol+0.15mol×24g/mol=9g。正确。
B.n(H2)=1.5n(Al)+n(Mg)=0.45mol,所以反应放出的氢气在标准状况下的体积为V(H2)=n(H2)·Vm =0.45mol×22.4L/mol=10.08L。但选项未指明气体的条件,故体积无法确定。错误。
D.因为在反应Al(OH)3+NaOH=NaAlO2+2H2O中,n(NaOH)=n[Al(OH)3]=0.2mol,V(NaOH)=40mL=0.04L,所以c(NaOH)=![]() =
=![]() =5mol/L,正确。
=5mol/L,正确。
C.当沉淀达到最大值时H2SO4恰好反应完全,此时的溶液为Na2SO4溶液,n(H2SO4)=![]() n(NaOH)。V((H2SO4) ·c(H2SO4) =
n(NaOH)。V((H2SO4) ·c(H2SO4) =![]() V(NaOH)c((NaOH), 0.2L×c(H2SO4) =
V(NaOH)c((NaOH), 0.2L×c(H2SO4) =![]() ×0.2L×5 mol/L。解得c(H2SO4)= 2.5 mol/L。正确。
×0.2L×5 mol/L。解得c(H2SO4)= 2.5 mol/L。正确。
故选B。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案【题目】氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O)的主要流程如下:
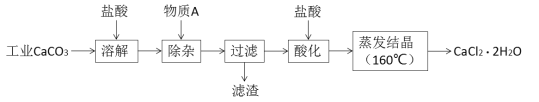
完成下列填空:
(1)除杂操作是加入物质A来调节溶液的pH,以除去溶液中的Al3+、Fe3+,根据下表所给信息,此时控制溶液的pH范围是_____________,加入的物质A是___________(写化学式)。
开始沉淀时的pH | 沉淀完全时的pH | 沉淀开始溶解时的pH | |
Al(OH)3 | 3.3 | 5.2 | 7.8 |
Fe(OH)3 | 1.5 | 4.1 | - |
(2)检验Fe3+是否沉淀完全的实验操作是____________________________________________。
(3)酸化操作是加入盐酸,调节溶液的pH,其目的是_________________________________。
(4)测定制得的样品的纯度,可采用如下方案:
a.称取0.750 g样品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用0.050 mol/L AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中,需要用到的玻璃仪器除了容量瓶、锥形瓶,还有__________________。
②计算上述样品中CaCl2·2H2O的质量分数为__________________(保留三位有效数字)。
③若配制和滴定操作均无误,但最终测定的样品中CaCl2·2H2O的质量分数偏高,写出可能导致该结果的一种情况___________________________________________。