题目内容
下列有关说法正确的是
A.0.1 mol/L NH4C1溶液加蒸馏水稀释,溶液的pH不断减小
B.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
C. 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应
D.0.1 mol/L的NaHA溶液,其pH=4: c(HA-) > c(H+)> c(H2A) > c(A2-)
B
解析

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案
相关题目
下列叙述正确的是 ( )
| A.将过量CO2气体通入水玻璃中可制得硅酸和纯碱 |
B.标准状况下,2.24L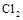 与过量稀NaOH溶液反应,转移电子0.1mol 与过量稀NaOH溶液反应,转移电子0.1mol |
| C.1L2mol·L-1明矾经水解可得到氢氧化铝胶体粒子数目为2×6.02×1023 |
| D.漂白粉溶于水能导电,故漂白粉是电解质 |
25℃时,已知弱酸的电离常数:K(CH3COOH) =" 1.8" ×10-5;K1(H2CO3) =" 4.4" ×10-7;K2(H2CO3) =" 4.7" × 10-11;K(HClO) =" 4.0" ×10-8。则下列说法正确的是
| A.新制氯水与碳酸氢钠不反应 |
| B.25℃时,0.1mol/L的醋酸溶液与0.01mol/L的醋酸溶液中,Ka前者小于后者 |
| C.NaClO溶液中通入少量二氧化碳的反应为:2NaClO+CO2+ H2O = Na2CO3 +2HClO |
| D.等物质的量浓度的碳酸钠溶液、醋酸钠溶液、次氯酸钠溶液的pH |
下列溶液中,微粒浓度关系正确的是
| A.含有NH4+、Cl-、H+、OH-离子的溶液中,其离子浓度一定是: c(Cl-)>c(NH4+)> c(H+)> c(OH-) |
| B.pH=6的醋酸与醋酸钠的混合溶液中c(Na+)>c(CH3COO-) |
| C.0.lmol/L的Na2S溶液中,c(OH-)= c(H+)+ c(HS-)+2 c(H2S) |
| D.pH=3的一种酸和pH=11的一种碱等体积混和后的溶液中一定是c(OH-)=c(H+) |
相同温度,浓度均为0.1mol /L,等体积的三种溶液:①HF溶液、②CH3COOH溶液、③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)的变化如右图所示,下列说法正确的是( )
| A.上述三种溶液中:c( OH-)大小:③ > ② > ① |
| B.物质酸性的比较:CH3COOH > HF > H2CO3 |
| C.反应结束后所得两溶液中: c ( CH3COO- ) > c ( F- ) |
| D.①和③反应结束后所得溶液中:c ( F- ) + c (HF) =" 0.10mol" /L |
下列图示与对应的叙述相符的是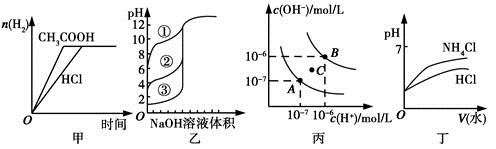
| A.图甲中曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉,产生H2的物质的量的变化 |
| B.图乙表示用0.1000 mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由曲线可确定③的酸性最强 |
| C.图丙为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
| D.图丁表示将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数时,二者pH的变化 |
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是 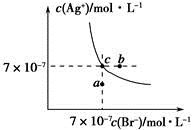
| A.在t℃时,AgBr的Ksp为4.9×10-13 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t℃时,AgCl(s)+Br-(aq)  AgBr(s)+Cl-(aq)平衡常数K≈816 AgBr(s)+Cl-(aq)平衡常数K≈816 |