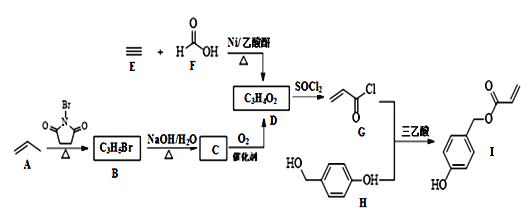
题目内容
【题目】硼氢化钠(NaBH4)是有机合成中常用的还原剂。一种制备硼氢化钠工艺如下(部分条件和产物省略):

已知:MgH2、NaBH4遇水蒸气剧烈反应并放出H2。
回答下列问题:
(1)Mg2B2O5H2O中B的化合价为_______________。MgH2和NaBO2必须在干燥条件下合成硼氢化钠,其原因是_____________________________________________。
(2)难溶的Mg2B2O5与浓氢氧化钠溶液反应的离子方程式为__________。
(3)SOCl2溶于水能产生两种气体,其中一种气体能使品红溶液褪色,则灼烧时加入SOCl2的目的是______________________________。
(4)已知镁—H2O2酸性燃料电池反应为Mg+H2O2+H2SO4![]() MgSO4+2H2O。常温下,电解质溶液为200 mL 0.1 mol·L1硫酸溶液。
MgSO4+2H2O。常温下,电解质溶液为200 mL 0.1 mol·L1硫酸溶液。
①写出正极的电极反应式:______________________________。
②若电路中有0.038 mol转移电子时,则溶液pH约为_____(忽略体积变化,不考虑H2O2电离)。
(5)“有效氢”是衡量含氢还原剂的还原能力指标,定义为1 g含氢还原剂的还原能力与多少克H2相当。NaBH4的“有效氢”等于_________________(结果保留2位小数)。
(6)工业上,可以利用NaBO2、HCHO和生石灰在加热下生成NaBH4和难溶的盐,写出化学方程式________________________________________。
【答案】+3 防止MgH2、NaBH4与水蒸气反应 Mg2B2O5+H2O+2OH=2Mg(OH)2+2BO2 提供HCl抑制MgCl2水解 H2O2+2e+2H=2H2O 2 0.21 NaBO2+2HCHO+2CaO![]() NaBH4+2CaCO3
NaBH4+2CaCO3
【解析】
Mg2B2O5H2O与NaOH反应,得到滤渣和滤液,从滤液中最终得到了NaBO2。从滤渣最终得到了MgCl2。滤液的溶质为NaBO2,经过蒸发浓缩等一系列操作得到晶体。滤渣为Mg(OH)2,与浓盐酸作用得到MgCl2·7H2O,经电解等一系列操作得MgH2,与NaBO2反应得到NaBH4。
(1)根据化合物中各元素的化合价代数和为0,Mg的化合价为+2,O的化合价为-2,设B的化合价为x,有2×(+2)+2x+5×(-2)=0,得x=+3。则B的化合价为+3。根据已知MgH2、NaBH4遇水蒸气剧烈反应并放出H2,所以保持干燥环境的目的是防止硼氢化钠、氢化镁与水蒸气反应。答案为+3;防止MgH2、NaBH4与水蒸气反应;
(2)Mg2B2O5H2O与NaOH反应,得到滤渣和滤液。滤液的溶质为NaBO2,因为经过蒸发浓缩等一系列操作得到NaBO2晶体,而一系列操作不会改变溶质。滤渣为Mg(OH)2,与浓盐酸作用得到MgCl2·7H2O。所以难溶的Mg2B2O5与浓氢氧化钠溶液反应生成了氢氧化镁和偏硼酸钠(NaBO2),方程式为Mg2B2O5+H2O+2OH =2Mg(OH)2+2BO2;
(3)MgCl2·7H2O脱去结晶水的时候要防止Mg2+水解生成Mg(OH)2。而SOCl2+H2O![]() SO2↑+2HCl↑,消耗了水,生成的氯化氢又能抑制氯化镁水解。答案为与水反应提供HCl抑制MgCl2水解
SO2↑+2HCl↑,消耗了水,生成的氯化氢又能抑制氯化镁水解。答案为与水反应提供HCl抑制MgCl2水解
(4)①正极得到电子化合价降低,化合价降低的为H2O2中的O,其化合价从-1降低到-2,发生还原反应。电解质溶液含有硫酸,为酸性,则正极方程式为H2O2+2e+2H=2H2O。
②n(H)=0.04 mol,由电极反应式知,转移1 mol电子必消耗1 mol H,转移0.038 mol电子时溶液中c(H)=![]() =0.01 mol·L1,pH=-lgc(H+)=-lg0.01=2。
=0.01 mol·L1,pH=-lgc(H+)=-lg0.01=2。
(5)含氢还原剂的氧化产物为H2O等,1 molNaBH4的质量为38g,发生反应时,失去8 mol电子,相当于4 molH2,为8g氢气。NaBH4的有效氢等于![]() ≈0.21。
≈0.21。
(6)反应物为NaBO2、HCHO和CaO,根据原子守恒难溶盐为CaCO3。则方程式为NaBO2+2HCHO+2CaO![]() NaBH4+2CaCO3。
NaBH4+2CaCO3。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案【题目】下列实验操作能达到实验目的的是( )
选项 | 实验操作 | 实验目的 |
A | 向盛有 | 检验某溶液中是否含有醛基 |
B | 向丙烯醛溶液中加入足量的银氨溶液,水浴加热,充分反应后,加入稀硫酸酸化后加入少量溴水 | 检验丙烯醛中的碳碳双键 |
C | 向淀粉溶液中加入稀硫酸,加热一段时间后,再加入银氨溶液 | 检验淀粉是否水解完全 |
D | 将氯乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合溶液中滴加硝酸银溶液 | 检验水解产物中的氯离子 |
A.AB.BC.CD.D