��Ŀ����
�������(K2FeO4)��һ�ּ�������������������һ������Ͷ��ˮ�������������������������£�

��ͬ���������⣺
(l)д����KOH��Һ��ͨ������Cl2������Ӧ�����ӷ���ʽ_______ ��
��2������ҺI�м���KOH�����Ŀ����______�����ţ���
��3������Һ���з����K2FeO4�����и���ƷKNO3��KCl,��Ӧ���з��������ӷ�Ӧ����ʽΪ_______��ÿ�Ƶ�59.4��K2FeO4�����������������������ʵ���Ϊ____ mol��
��4���������(K2FeO4)��Ϊˮ��������һ���ŵ�������ˮ��Ӧ���ɽ����������ʣ���ƽ�÷�Ӧ�����ӷ���ʽ��_______ FeO42��+_______ H2O="_______" Fe(OH)3�����壩+_______O2��+_______OH����
��5���ӻ��������ĽǶȿ����Ʊ�K2FeO4�Ϻõķ���Ϊ��ⷨ����װ����ͼ��ʾ���������������ĵ缫��ӦʽΪ________��

��6�����������һ�����Ͷ��ε�أ����ҺΪ����Һ���䷴ӦʽΪ��3Zn(OH)2+2Fe(OH)3+4KOH-----3Zn+2K2FeO4+8H2O,�ŵ�ʱ��صĸ�����ӦʽΪ________ ��

��ͬ���������⣺
(l)д����KOH��Һ��ͨ������Cl2������Ӧ�����ӷ���ʽ_______ ��
��2������ҺI�м���KOH�����Ŀ����______�����ţ���
| A��Ϊ��һ����Ӧ�ṩ���ԵĻ��� |
| B��ʹKClO3ת��ΪKClO |
| C������ҺI�й�����Cl2������Ӧ�����ɸ����KClO |
| D��KOH�����ܽ�ʱ��ų��϶����������������߷�Ӧ���� |
��4���������(K2FeO4)��Ϊˮ��������һ���ŵ�������ˮ��Ӧ���ɽ����������ʣ���ƽ�÷�Ӧ�����ӷ���ʽ��_______ FeO42��+_______ H2O="_______" Fe(OH)3�����壩+_______O2��+_______OH����
��5���ӻ��������ĽǶȿ����Ʊ�K2FeO4�Ϻõķ���Ϊ��ⷨ����װ����ͼ��ʾ���������������ĵ缫��ӦʽΪ________��

��6�����������һ�����Ͷ��ε�أ����ҺΪ����Һ���䷴ӦʽΪ��3Zn(OH)2+2Fe(OH)3+4KOH-----3Zn+2K2FeO4+8H2O,�ŵ�ʱ��صĸ�����ӦʽΪ________ ��
��1��2OH-+Cl2=ClO-+Cl-+H2O ��2�� AC ��3�� 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O 0.45
��4�� 4FeO42- +10H2O 4Fe(OH)3 (����) +3O2��+8 OH- ��5�� Fe+8OH��6e-= FeO42- -+4H2O
4Fe(OH)3 (����) +3O2��+8 OH- ��5�� Fe+8OH��6e-= FeO42- -+4H2O
��6��Zn+2OH��2e-=Zn(OH)2��Zn+2OH=Zn(OH)2+2e-��
��4�� 4FeO42- +10H2O
 4Fe(OH)3 (����) +3O2��+8 OH- ��5�� Fe+8OH��6e-= FeO42- -+4H2O
4Fe(OH)3 (����) +3O2��+8 OH- ��5�� Fe+8OH��6e-= FeO42- -+4H2O��6��Zn+2OH��2e-=Zn(OH)2��Zn+2OH=Zn(OH)2+2e-��
���������(l) KOH��Һ������Cl2������Ӧ�����ӷ���ʽΪ2OH-+Cl2=ClO-+Cl-+H2O����2������ҺI�м���KOH�����Ŀ����Ϊ��һ����Ӧ�ṩ���ԵĻ���������ҺI�й�����Cl2������Ӧ�����ɸ����KClO����ѡ��ΪA. C����3�� ��Ӧ���з��������ӷ�Ӧ����ʽΪ2Fe3++3ClO-+10OH-=2FeO42-+ Cl-+5H2O .�ڷ���ʽ��ÿ����2mol��FeO42-ת�Ƶ���6mol.����������3mol.����n(K2FeO4)= 59.4g��198g/mol=0.3mol�������������������ʵ���Ϊ3��2��0.3mol=0.45mol.��4�� �������(K2FeO4)ˮ������ӷ���ʽΪ4FeO42- +10H2O
 4Fe(OH)3 (����) +3O2��+8 OH-��5�� ��ⷨ���Ʊ�K2FeO4�Ϻõķ�����Fe���������缫��ӦΪFe+8OH��6e-= FeO42- +4H2O��ʯī���������缫��ӦΪ��O2+ 2H2O+4e-=4OH��.��6��������طŵ�ʱ��صĸ�����ӦʽΪZn+2OH��2e-=Zn(OH)2��2FeO4)���Ʒ���ԭ��������ת�Ƽ�������صȷ�Ӧԭ����֪ʶ��
4Fe(OH)3 (����) +3O2��+8 OH-��5�� ��ⷨ���Ʊ�K2FeO4�Ϻõķ�����Fe���������缫��ӦΪFe+8OH��6e-= FeO42- +4H2O��ʯī���������缫��ӦΪ��O2+ 2H2O+4e-=4OH��.��6��������طŵ�ʱ��صĸ�����ӦʽΪZn+2OH��2e-=Zn(OH)2��2FeO4)���Ʒ���ԭ��������ת�Ƽ�������صȷ�Ӧԭ����֪ʶ��
��ϰ��ϵ�д�
�����Ŀ
 mol
mol mol
mol L
L ��
�� CO2(g)+C(s)���Է����У���÷�Ӧ�ġ�H��0
CO2(g)+C(s)���Է����У���÷�Ӧ�ġ�H��0 4NH3 (g)+3O2 (g) - Q �������Ӧ��ƽ�ⳣ��Kֵ��÷�Ӧ ��ѡ���ţ���
4NH3 (g)+3O2 (g) - Q �������Ӧ��ƽ�ⳣ��Kֵ��÷�Ӧ ��ѡ���ţ��� ��N2��/
��N2��/  ��O2��=2:3
��O2��=2:3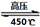 6H2O��+ 2N2��+ 4HCl��+ 5O2�����������������뻹ԭ��������ʵ���֮���� ��ÿ�ֽ�1mol������泥�ת�Ƶĵ�����Ŀ�� ��
6H2O��+ 2N2��+ 4HCl��+ 5O2�����������������뻹ԭ��������ʵ���֮���� ��ÿ�ֽ�1mol������泥�ת�Ƶĵ�����Ŀ�� ��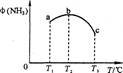
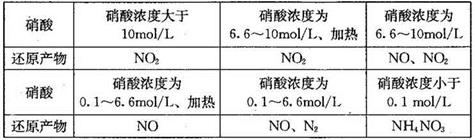


 KClO3 + 5KCl + 3H2O������˵����ȷ����
KClO3 + 5KCl + 3H2O������˵����ȷ����