题目内容
合成氨和制备硝酸是两种重要的化工生产,重庆某化工厂将合成氨与制备硝酸进行连续生产。
(1)在某温度下体积为200 L的氨合成塔中,以分为单位的时间点上测得各物质的浓度(mol·L﹣1)如下表:
根据表中数据得知0 min~2 min内N2的平均反应速率是_______,若3 min末N2的转化率为a,则此时H2的转化率为_______ (用含a的代数式表示)。
(2)今对合成氨反应进行如下研究:在容积均为10 L的a、b、c三个相同密闭容器中分别充入1 mol N2和3 mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5 min时,NH3的体积分数如图所示。则下列说法正确的是_______。
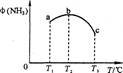
A.a、b、C三容器5 min时的正反应速率大小为:b>a>c
B.达到平衡时,a、b、c中N2转化率为a>b>c
C.5min时,a、b、c三容器中的反应均可能达到平衡状态。
D.将容器b中的平衡状态转变到容器c中的平衡状态,可采取的措施有升温或减压
(3)已知:N2(g)+O2(g)=2NO(g): △H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=﹣905 kJ/mol
2H2(g)+O2(g)=2H2O(g); △H=﹣483.6 kJ/mol
则在该条件下,氨合成塔中所发生反应的热化学方程式为:____________________________;
(4)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,写出该反应的离子方程式:_________________________________________;
(5)取200 mL的硝酸恰好与32 g Cu2S完全反应,已知硝酸被还原成等物质的量的NO和NO2,另外还有CuSO4和Cu(NO3)2生成,则所得工业硝酸的浓度是_______mol·L﹣1。
(1)在某温度下体积为200 L的氨合成塔中,以分为单位的时间点上测得各物质的浓度(mol·L﹣1)如下表:
| | 0 min | l min | 2 min | 3 min | 4 min |
| N2 | 1.500 | 1.400 | 1.200 | c1 | c1 |
| H2 | 4.500 | 4.200 | 3.600 | c2 | c2 |
| NH3 | 0 | 0.200 | 0.600 | c3 | c3 |
根据表中数据得知0 min~2 min内N2的平均反应速率是_______,若3 min末N2的转化率为a,则此时H2的转化率为_______ (用含a的代数式表示)。
(2)今对合成氨反应进行如下研究:在容积均为10 L的a、b、c三个相同密闭容器中分别充入1 mol N2和3 mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5 min时,NH3的体积分数如图所示。则下列说法正确的是_______。

A.a、b、C三容器5 min时的正反应速率大小为:b>a>c
B.达到平衡时,a、b、c中N2转化率为a>b>c
C.5min时,a、b、c三容器中的反应均可能达到平衡状态。
D.将容器b中的平衡状态转变到容器c中的平衡状态,可采取的措施有升温或减压
(3)已知:N2(g)+O2(g)=2NO(g): △H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=﹣905 kJ/mol
2H2(g)+O2(g)=2H2O(g); △H=﹣483.6 kJ/mol
则在该条件下,氨合成塔中所发生反应的热化学方程式为:____________________________;
(4)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,写出该反应的离子方程式:_________________________________________;
(5)取200 mL的硝酸恰好与32 g Cu2S完全反应,已知硝酸被还原成等物质的量的NO和NO2,另外还有CuSO4和Cu(NO3)2生成,则所得工业硝酸的浓度是_______mol·L﹣1。
(1)0.15mol·L-1·min (2分);a(2分)
(2)BD(2分)
(3)N2(g)+ 3H2(g) =2NH3(g) △H= ﹣92.4kJ/mol(3分)
(4)Cu+NH3·H2O+H2O2=[Cu(NH3)4]2+ +4H2O+OH-(3分)
(5)7(3分)
(2)BD(2分)
(3)N2(g)+ 3H2(g) =2NH3(g) △H= ﹣92.4kJ/mol(3分)
(4)Cu+NH3·H2O+H2O2=[Cu(NH3)4]2+ +4H2O+OH-(3分)
(5)7(3分)
试题分析:(1)根据表中数据可知,在2min内N2的反应速率v(N2)=(1.5-1.2)mol·L﹣1 /2min="0.15" mol·L-1·min;起始时N2 : H2 =1:3,跟方程式的系数比相等,所以N2 、H2 的转化率相等,均为a。
(2)如图,三种温度下反应到5min时,氨气的体积分数不同,根据图像呈现的趋势,氨气的体积分数随温度的升高先升后降,说明在T1 条件下的反应在5min时还没有达到平衡,而在T3条件下反应5,min时已经达到平衡,而且相比T2条件下的反应,升高温度反应逆向移动,正反应为放热:
A.温度越高,反应速率越大,所以a、b、c三容器5min时的正反应反应速率大小为c > b > a,错误。
B.根据上述分析,正反应放热反应,所以温度越高,平衡逆向移动,平衡时候N2转化率越低,所以a>b>c,B正确。
C.根据上述分析,a容器未达平衡,b、c达到平衡,C错误。
D.容器b要变成c的平衡状态,则平衡要逆向移动,则可采取升高温度或者减小压强的措施,D正确。
(3)利用盖斯定律和已知方程式,由①-1/2②+3/2③可得合成氨的热化学方程式为:N2(g)+ 3H2(g) =2NH3(g) △H= ﹣92.4kJ/mol。
(4) 金属Cu与氨水和双氧水的混合溶液反应生成深蓝色溶液,发生了氧化还原反应,且生成了配合离子,可以类比银氨溶液中的银铵离子[Ag(NH3)2]2+ ,所以生成的配合离子为[Cu(NH3)4]2+ ,反应方程式为:Cu+NH3·H2O+H2O2=[Cu(NH3)4]2+ +4H2O+OH- 。
(5)根据题意得:n(Cu2S)=" 32" g/160g/mol=0.2mol,硝酸与硫化亚铜反应,硝酸为氧化剂和酸,而Cu和S均被氧化,Cu由 +1→+2价, S由-2→+6价,所以失去的电子总数n(e-)=" n(Cu)+8" n(S)=0.4mol+1.6mol=2mol,又n(CuSO4)= n(Cu(NO3)2)=0.2mol,所以作酸的部分硝酸n(HNO3)= 2n(Cu(NO3)2)=0.4mol,作氧化剂的硝酸化合价变化+5→+2价,+5→+4价,且n(NO)= n(NO2),所以的电子总数n(e-)=" 3n(NO)+" n(NO2)="4" n(NO),得失电子守恒,所以有4 n(NO) =2mol,所以可得n(NO)= n(NO2)=0.5mol,所以作氧化剂的硝酸n(HNO3)=" n(NO)+" n(NO2)=1mol,所以总的硝酸n(HNO3)= 0.4mol+1mol=1.4mol,所以硝酸的浓度c(HNO3)=" 1.4mol" /0.2 L=7mol/L。

练习册系列答案
相关题目


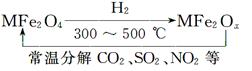


 MnCl2+Cl2↑+ 2H2O
MnCl2+Cl2↑+ 2H2O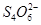 +2H2O下列说法中,不正确的是 ( )
+2H2O下列说法中,不正确的是 ( )