题目内容
20.镁铝合金5.1g溶于300mL 2mol•L-1的盐酸中,在标准状况下放出气体的体积为5.6L.向反应后的溶液中加入足量氨水,产生沉淀的质量为( )| A. | 5.1 g | B. | 10.2 g | C. | 13.6 g | D. | 15.3 g |
分析 发生反应Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,5.6L气体是氢气,氢气的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,故参加反应的HCl的物质的量为0.25mol×2=0.5mol,溶液中n(HCl)=0.3L×2mol/L=0.6mol,大于参加反应的HCl的物质的量,故金属完全反应,反应后溶液中加入足量氨水,则镁离子、铝离子恰好完全转化为Mg(OH)2、Al(OH)3,则m(沉淀)=m(金属)+m(OH-),由生成的氢气的物质的量,根据电子注意守恒计算n(OH-),再根据m=nM计算m(OH-),最后计算出沉淀的质量.
解答 解:发生反应Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,5.6L气体是氢气,氢气的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,故参加反应的HCl的物质的量为0.25mol×2=0.5mol,溶液中n(HCl)=0.3L×2mol/L=0.6mol>0.5mol,则金属完全反应,
反应后溶液中加入足量氨水,镁离子、铝离子恰好完全转化为Mg(OH)2、Al(OH)3,
则m(沉淀)=m(金属)+m(OH-),
根据电子守恒可知:n(OH-)=2n(H2)=0.25mol×2=0.5mol,
所以生成沉淀的质量为5.1g+0.5mol×17g/mol=13.6g,
故选C.
点评 本题考查氧化还原反应的计算,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意电子守恒确定氢氧根离子的物质的量,题目难度中等.

练习册系列答案
相关题目
11.下列各组物质相互混合反应后,最终有白色沉淀生成的是( )
①少量Ca(OH)2投入过量NaHCO3溶液中
②过量NaOH溶液和明矾溶液混合
③金属钠投入到FeCl2中
④向NaAlO2溶液中通入过量CO2
⑤向饱和Na2CO3溶液中通入过量CO2.
①少量Ca(OH)2投入过量NaHCO3溶液中
②过量NaOH溶液和明矾溶液混合
③金属钠投入到FeCl2中
④向NaAlO2溶液中通入过量CO2
⑤向饱和Na2CO3溶液中通入过量CO2.
| A. | ①②③④⑤ | B. | 只有①④⑤ | C. | 只有②③ | D. | 只有③④ |
8.反应4A(s)+3B(g)═2C(g)+xD(g),经2min后B的浓度减少了1.2mol/L,下列反应速率的表示正确的是( )
| A. | 用A表示的反应速率是0.8mol/(L•min) | |
| B. | 2min末时的反应速率,用B表示为0.6mol/(L•min) | |
| C. | 用C表示的反应速率是0.4mol/(L•min) | |
| D. | 若用D表示反应速率是0.8mol/(L•min),则x=2 |
15.某工厂以孔雀石为主要原料制备蓝矾晶体(CuSO4•5H2O),其生产流程如图1所示:
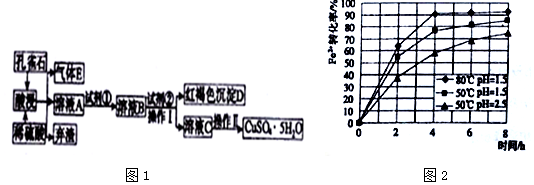
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+生成沉淀的pH分别如表所示:
回答下列问题:
(1)弃渣的主要成分是SiO2,Ⅱ中有“洗涤”的操作,其目的是除去晶体表面附着的杂质.
(2)溶液A中的金属离子有Cu2+、Fe2+、Fe3+.试剂①是一种氧化剂,则试剂①最好为下列中的b,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O.
a.Na2O2b.H2O2 c.Cl2 d.KSCN
(3)根据图2有关数据,你认为工业上氧化操作时应采取措施将反应温度及溶液pH分别控制在80℃,pH=1.5,氧化时间为4h左右.
(4)操作Ⅰ中溶液的pH应控制在3.2≤pH<4.7范围内.
(5)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液进行滴定,则KMnO4溶液应置于酸(填“酸”或“碱”)式滴定管中.若滴定20.00mLA的溶液,用去0.0240mol•L-1KMnO4溶液16.00mL时恰好达到滴定终点,则A溶液中Fe2+的浓度为0.096mol/L.

已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+生成沉淀的pH分别如表所示:
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 4.7 | 6.4 |
(1)弃渣的主要成分是SiO2,Ⅱ中有“洗涤”的操作,其目的是除去晶体表面附着的杂质.
(2)溶液A中的金属离子有Cu2+、Fe2+、Fe3+.试剂①是一种氧化剂,则试剂①最好为下列中的b,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O.
a.Na2O2b.H2O2 c.Cl2 d.KSCN
(3)根据图2有关数据,你认为工业上氧化操作时应采取措施将反应温度及溶液pH分别控制在80℃,pH=1.5,氧化时间为4h左右.
(4)操作Ⅰ中溶液的pH应控制在3.2≤pH<4.7范围内.
(5)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液进行滴定,则KMnO4溶液应置于酸(填“酸”或“碱”)式滴定管中.若滴定20.00mLA的溶液,用去0.0240mol•L-1KMnO4溶液16.00mL时恰好达到滴定终点,则A溶液中Fe2+的浓度为0.096mol/L.
12.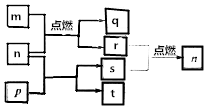 短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )
 短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )| A. | Y、Z、W的简单离子的电子层结构相同 | |
| B. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| C. | 简单氢化物的稳定性:X>Y | |
| D. | Y与Z两种元素形成的化合物一定只含离子键 |
7.硒鼓回收料含硒约97%,其余为约3%的碲和微量的氯.从该回收料中回收硒的工艺流程如图所示(已知煅烧过程中,回收料中的硒、碲被氧化成SeO2和TeO2):

部分物质的物理性质如表:
回答下列问题:
(1)Se与S是同族元素,比S多1个电子层,Se在元素周期表的位置为第四周期ⅥA族;H2Se的热稳定性比H2S的热稳定性弱(填“强”或“弱”).
(2)乙醇浸取后过滤所得滤渣的主要成分是TeO2.蒸发除去溶剂后,所得固体中仍含有少量TeO2杂质,除杂时适宜采用的方法是升华.
(3)SeO2易溶于水得到H2SeO3溶液,向溶液中通入HI气体后,再加入淀粉溶液,溶液变蓝色,同时生成Se沉淀,写出反应的化学方程式H2SeO3+4HI=Se↓+2I2+3H2O.
(4)已知H2SeO3的电离常数K1=3.5×10-3、K2=5.0×10-8,回答下列问题:
①Na2SeO3溶液呈碱性,原因是(用离子方程式表示)SeO32-+H2O?HSeO3-+OH-;
②在Na2SeO3溶液中,下列关系式正确的是C:
A.c(Na+)+c(H+)═c(SeO32-)+c(HSeO3-)+c(OH-)
B.2c(Na+)═c(SeO32-)+c(HSeO3-)+c(H2SeO3)
C.c(Na+)═2c(SeO32-)+2c(HSeO3-)+2c(H2SeO3)
D.c(OH-)═c(H+)+c(HSeO3-)+c(H2SeO3)

部分物质的物理性质如表:
| 物质 | 熔点 | 沸点 | 溶解度 |
| SeO2 | 340℃(315℃升华) | 684℃ | 易溶于水和乙醇 |
| TeO2 | 733℃(450℃升华) | 1260℃ | 微溶于水,不溶于乙醇 |
(1)Se与S是同族元素,比S多1个电子层,Se在元素周期表的位置为第四周期ⅥA族;H2Se的热稳定性比H2S的热稳定性弱(填“强”或“弱”).
(2)乙醇浸取后过滤所得滤渣的主要成分是TeO2.蒸发除去溶剂后,所得固体中仍含有少量TeO2杂质,除杂时适宜采用的方法是升华.
(3)SeO2易溶于水得到H2SeO3溶液,向溶液中通入HI气体后,再加入淀粉溶液,溶液变蓝色,同时生成Se沉淀,写出反应的化学方程式H2SeO3+4HI=Se↓+2I2+3H2O.
(4)已知H2SeO3的电离常数K1=3.5×10-3、K2=5.0×10-8,回答下列问题:
①Na2SeO3溶液呈碱性,原因是(用离子方程式表示)SeO32-+H2O?HSeO3-+OH-;
②在Na2SeO3溶液中,下列关系式正确的是C:
A.c(Na+)+c(H+)═c(SeO32-)+c(HSeO3-)+c(OH-)
B.2c(Na+)═c(SeO32-)+c(HSeO3-)+c(H2SeO3)
C.c(Na+)═2c(SeO32-)+2c(HSeO3-)+2c(H2SeO3)
D.c(OH-)═c(H+)+c(HSeO3-)+c(H2SeO3)
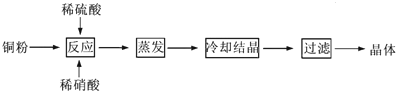
 ②实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定.滴定过程中若用酚酞作指示剂,终点现象是溶液由无色变成红色(或浅红色),且半分钟内不褪色.请在图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点).
②实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定.滴定过程中若用酚酞作指示剂,终点现象是溶液由无色变成红色(或浅红色),且半分钟内不褪色.请在图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点).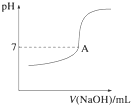 .
.
