题目内容
8.反应4A(s)+3B(g)═2C(g)+xD(g),经2min后B的浓度减少了1.2mol/L,下列反应速率的表示正确的是( )| A. | 用A表示的反应速率是0.8mol/(L•min) | |
| B. | 2min末时的反应速率,用B表示为0.6mol/(L•min) | |
| C. | 用C表示的反应速率是0.4mol/(L•min) | |
| D. | 若用D表示反应速率是0.8mol/(L•min),则x=2 |
分析 经2min后B的浓度减少了1.2mol/L,则v(B)=$\frac{1.2mol/L}{2min}$=0.6mol/(L•min),结合速率之比等于化学计量数之比计算.
解答 解:经2min后B的浓度减少了1.2mol/L,则v(B)=$\frac{1.2mol/L}{2min}$=0.6mol/(L•min),
A.A为固体,不能表示反应速率,故A错误;
B.反应速率为平均速率,不能计算瞬时速率,故B错误;
C.由速率之比等于化学计量数之比可知,C表示的反应速率是0.6mol/(L•min)×$\frac{2}{3}$=0.4mol/(L•min),故C正确;
D.若用D表示反应速率是0.8mol/(L•min),$\frac{0.8}{0.6}=\frac{x}{3}$,解得x=4,故D错误;
故选C.
点评 本题考查反应速率与化学计量数的关系,为高频考点,把握化学速率之比等于化学计量数之比为解答的关键,侧重分析与应用能力的考查,注意A、B为易错点,题目难度不大.

练习册系列答案
相关题目
3.实验:用脱脂棉包住0.2g Na2O2粉末,放在石棉网上,在脱脂棉上滴加几滴水;可以观察到脱脂棉剧烈燃烧起来.此实验的分析正确的是( )
| A. | Na2O2在反应中只作氧化剂 | |
| B. | 由于Na2O2与H2O反应放出热量和氧气,所以脱脂棉剧烈燃烧 | |
| C. | Na2O2与H2O反应中有氢氧化钠生成,Na2O2是典型的碱性氧化性 | |
| D. | Na2O2与H2O反应中有氧气生成,可用于防毒面具上 |
13.金属钛(Ti)被誉为21世纪金属,具有良好的生物相容性,它兼具铁的高强度和铝的低密度,其单质和化合物具有广泛的应用价值.氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2(如图1).
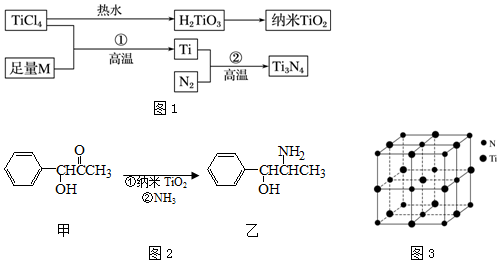
图中的M是短周期金属元素,M的部分电离能如下表:
请回答下列问题:
(1)Ti的基态原子外围电子排布式为3d24s2.
(2)M是Mg(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为12.
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示.化合物甲的分子中采取sp2方式杂化的碳原子有7 个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C.
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为$\frac{4×62}{{{N_A}×(2a×{{10}^{-10}}{)^3}}}$g•cm-3(NA为阿伏加德罗常数的值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12.
(5)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据如下:
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为TiN>CaO>KCl.

图中的M是短周期金属元素,M的部分电离能如下表:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
(1)Ti的基态原子外围电子排布式为3d24s2.
(2)M是Mg(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为12.
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示.化合物甲的分子中采取sp2方式杂化的碳原子有7 个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为O>N>C.
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为$\frac{4×62}{{{N_A}×(2a×{{10}^{-10}}{)^3}}}$g•cm-3(NA为阿伏加德罗常数的值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12.
(5)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据如下:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
20.镁铝合金5.1g溶于300mL 2mol•L-1的盐酸中,在标准状况下放出气体的体积为5.6L.向反应后的溶液中加入足量氨水,产生沉淀的质量为( )
| A. | 5.1 g | B. | 10.2 g | C. | 13.6 g | D. | 15.3 g |
17.0.154mol/L的NaCl溶液的渗透液浓度(mmol/L表示)为( )
| A. | 0.308 | B. | 308 | C. | 154 | D. | 0.154 |
15.S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的反应原理有两种:
①CS2+3Cl2$\frac{\underline{\;95-100℃\;}}{\;}$CCl4+S2Cl2;
②2S+Cl2$\frac{\underline{\;111-140℃\;}}{\;}$S2Cl2.
已知:S2Cl2易与水反应;S2Cl2+Cl2$\stackrel{△}{?}$2SCl2.
下表是几种物质的熔沸点,如图是反应装置图:
(1)利用上图装置(部分夹持仪器已略去)来制备S2Cl2,反应原理是①(填写以上两种反应原理的数字序号).
(2)若装置C更换成干燥管,则装置C中可选用的固体试剂是无水CaCl2(或固体P2O5).
(3)D装置中冷凝管的作用是冷凝、回流、导气;反应结束后,将D装置锥形瓶内的混合物中分离出产物的方法是蒸馏.
(4)S2Cl2与足量水反应有黄色沉淀生成,产生的无色气体能使品红溶液褪色,则该反应的化学方程式为2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑.
(5)为了提高制得的产品S2Cl2的纯度,关键的操作是控制好温度和控制浓盐酸的滴速不能太快.
(6)上图尾部装置不够完善,改进措施是在D和E之间增加干燥装置,同时尾气吸收要防倒吸.
(7)若A中消耗了26.1g MnO2,得到10.8g产品,本实验的产率是80%.
①CS2+3Cl2$\frac{\underline{\;95-100℃\;}}{\;}$CCl4+S2Cl2;
②2S+Cl2$\frac{\underline{\;111-140℃\;}}{\;}$S2Cl2.
已知:S2Cl2易与水反应;S2Cl2+Cl2$\stackrel{△}{?}$2SCl2.

下表是几种物质的熔沸点,如图是反应装置图:
| 物质 | 沸点/℃ | 熔点/℃ |
| S | 445 | 113 |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
(2)若装置C更换成干燥管,则装置C中可选用的固体试剂是无水CaCl2(或固体P2O5).
(3)D装置中冷凝管的作用是冷凝、回流、导气;反应结束后,将D装置锥形瓶内的混合物中分离出产物的方法是蒸馏.
(4)S2Cl2与足量水反应有黄色沉淀生成,产生的无色气体能使品红溶液褪色,则该反应的化学方程式为2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑.
(5)为了提高制得的产品S2Cl2的纯度,关键的操作是控制好温度和控制浓盐酸的滴速不能太快.
(6)上图尾部装置不够完善,改进措施是在D和E之间增加干燥装置,同时尾气吸收要防倒吸.
(7)若A中消耗了26.1g MnO2,得到10.8g产品,本实验的产率是80%.
