题目内容
(10分)有A、B、C、D、E、F六种元素,已知:
①它们位于三个不同短周期,核电荷数依次增大 ②B与F同主族。
③B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
④A、E分别都能与D按原子个数比1∶1或2∶1形成化合物。
⑤E元素的电离能数据如下 (kJ·mol-1):
(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式__________、__________。
(2)B2A2分子中存在______个σ键,______个π键。
(3)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
试计算1 mol F单质晶体燃烧时的反应热ΔH=_____ (要写单位)。
①它们位于三个不同短周期,核电荷数依次增大 ②B与F同主族。
③B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
④A、E分别都能与D按原子个数比1∶1或2∶1形成化合物。
⑤E元素的电离能数据如下 (kJ·mol-1):
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
(2)B2A2分子中存在______个σ键,______个π键。
(3)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
| 化学键 | F—D | F—F | B—B | F—B | C—D | D—D |
| 键能/kJ·mol-1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
(1)NaHCO3 CH3COONa(或其他有机酸的盐) (2)3 2 (3)-990.7 kJ/mol
根据E元素的电离能可判断,E是第IA。又因为的E的原子序数仅小于F的,所以E是钠元素。则D是氧元素,所以A是氢元素,B是碳元素,C是氮元素,F是硅元素。
(1)有H、C、O、Na形成的无水盐是NaHCO3和CH3COONa(或其他有机酸的盐)。
(2)乙炔分子中还有碳碳三键,因为单键全部是σ键,三键是由1个σ键和2个π键构成的。是由乙炔分子中含有3个σ键和2个π键。
(3)硅燃烧的化学方程式为Si+O2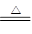 SiO2,所以根据反应热的概念可知,该反应的反应热是
SiO2,所以根据反应热的概念可知,该反应的反应热是
176kJ/mol×2+497.3kJ/mol- 460kJ/mol×4=-990.7 kJ/mol。
(1)有H、C、O、Na形成的无水盐是NaHCO3和CH3COONa(或其他有机酸的盐)。
(2)乙炔分子中还有碳碳三键,因为单键全部是σ键,三键是由1个σ键和2个π键构成的。是由乙炔分子中含有3个σ键和2个π键。
(3)硅燃烧的化学方程式为Si+O2
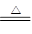 SiO2,所以根据反应热的概念可知,该反应的反应热是
SiO2,所以根据反应热的概念可知,该反应的反应热是176kJ/mol×2+497.3kJ/mol- 460kJ/mol×4=-990.7 kJ/mol。

练习册系列答案
相关题目

 B.
B. C.
C.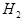 D.
D.