题目内容
【题目】用NH3催化还原氮的氧化物,可以消除氮的氧化物的污染。已知:
反应①:4NH3(g)+ 6NO(g)![]() 5N2(g) + 6H2O(l)
5N2(g) + 6H2O(l) ![]()
反应②:2NO(g) + O2(g) ![]() 2NO2(g)
2NO2(g) ![]() (
( ![]() < 0且
< 0且![]() =2
=2![]() )
)
反应③:4NH3(g) + 6NO2(g)![]() 5N2(g)+ 3O2 + 6H2O(l)
5N2(g)+ 3O2 + 6H2O(l) ![]()
反应①和反应②在不同温度时的平衡常数及其大小关心如下表:
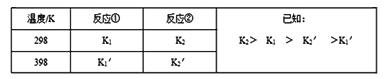
(1)试推测反应③是______ 反应(填“吸热”或“放热”)。
(2)相同条件下反应①在2L的密闭容器中选用不同的催化剂,反应产生N2的物质的量随时间的变化如图所示。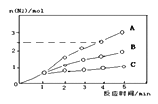
则:①计算0~4min时在A催化剂作用下,反应速率v(NO)=_______________
②下列说法正确的是:________________________
A.该反应的活化能大小顺序是:Ea(A)>Ea(B) >Ea(C)
B.增大压强能使反应速率加快的原因,是因为增加活化分子的百分数
C.单位时间内H-O键与N-H断裂的数目相等时,说明反应已达平衡状态
D.若在恒容绝热的密闭容器中进行,当温度不变时,说明反应已达平衡状态
(3)对于反应②,若在某温度下,在容积为2L的刚性密闭容器中起始加入2 molNO 和2 molO2,反应一段时间后,测的生成NO21.6mol,则该反应是否达到平衡状态?_________(填“是”或“不是”已知该温度下该反应的K约为147.3).达平衡后,在同一温度下向大小相同的另一刚性容器中加入1.2mol的NO2和1.5mol的O2,则还要加入NO______mol、O2_____mol,达平衡时各物质的浓度才能跟前平衡的相等。
【答案】 吸热 v(NO) = 0.375mol//(Lmin) C D 不是 0.8mol 0.5mol
【解析】(1)由盖斯定律可知: ![]() H3=
H3=![]() H1-3
H1-3![]() H2,又因为|
H2,又因为|![]() H1|=2|
H1|=2|![]() H2|,又由表中不同温度下的K值可知K2>K1>
H2|,又由表中不同温度下的K值可知K2>K1>![]() >
>![]() ,故反应①、②温度升高平衡逆向移动,故
,故反应①、②温度升高平衡逆向移动,故![]() H1<
H1<![]() H2<0,故
H2<0,故![]() H3=
H3=![]() H1-3
H1-3![]() H2=-
H2=-![]() H2>0,则反应③为吸热反应;(2)①由图中图象可知0~4min在A催化剂作用下,反应速率v(NO)=
H2>0,则反应③为吸热反应;(2)①由图中图象可知0~4min在A催化剂作用下,反应速率v(NO)= 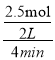 =0.375mol/(Lmin);②A、由图象可知催化效果越好故活化能越低,故该反应的活化能大小顺序是:Ea(A)<Ea(B) <Ea(C),选项A错误;B、增大压强能使单位体积内的活化分子数目增多,则有效碰撞次数增多,反应速率加快,但分子本身能量与该反应的活化能均不变,故活化分子百分数不变,选项B错误;C、单位时间内H-O键与N-H键断裂的数目相等时,说明该反应正逆反应速率相同,反应已达到平衡,选项C正确;D、该反应为放热反应,则若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应体系温度不再发生变化,故反应已经达到平衡,选项D正确。答案选CD;
=0.375mol/(Lmin);②A、由图象可知催化效果越好故活化能越低,故该反应的活化能大小顺序是:Ea(A)<Ea(B) <Ea(C),选项A错误;B、增大压强能使单位体积内的活化分子数目增多,则有效碰撞次数增多,反应速率加快,但分子本身能量与该反应的活化能均不变,故活化分子百分数不变,选项B错误;C、单位时间内H-O键与N-H键断裂的数目相等时,说明该反应正逆反应速率相同,反应已达到平衡,选项C正确;D、该反应为放热反应,则若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应体系温度不再发生变化,故反应已经达到平衡,选项D正确。答案选CD;
(3) 2NO(g) + O2(g) ![]() 2NO2(g)
2NO2(g)
开始时的浓度(mol/L) 1 1 0
改变的浓度(mol/L) 0.8 0.4 0.8
某时刻的浓度(mol/L) 0.2 0.6 0.8
Q=![]() =26.67 <K=147.3,则该反应还没有达到平衡状态;反应为2NO(g) + O2(g)
=26.67 <K=147.3,则该反应还没有达到平衡状态;反应为2NO(g) + O2(g) ![]() 2NO2(g)气体体积变化的反应,根据恒温恒容等效平衡原理,反应物极限转化为同一边的物质的物质的量相同时,达到平衡时等效,则达平衡后,在同一温度下向大小相同的另一刚性容器中加入1.2mol的NO2和1.5mol的O2,则还要加入NO为2mol-1.2mol=0.8mol、O2为2mol-1.5mol=0.5mol,达平衡时各物质的浓度才能跟前平衡的相等。
2NO2(g)气体体积变化的反应,根据恒温恒容等效平衡原理,反应物极限转化为同一边的物质的物质的量相同时,达到平衡时等效,则达平衡后,在同一温度下向大小相同的另一刚性容器中加入1.2mol的NO2和1.5mol的O2,则还要加入NO为2mol-1.2mol=0.8mol、O2为2mol-1.5mol=0.5mol,达平衡时各物质的浓度才能跟前平衡的相等。

 名校课堂系列答案
名校课堂系列答案
