题目内容
硬铝废料(含90%铝、2.5%镁和7.5%铜)可制取明矾 KAl(SO4)2·12H2O,某探究小组设计了下列实验。
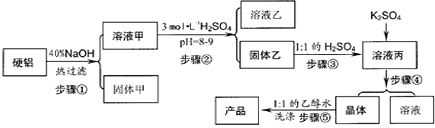
请回答以下问题:
(1)写出步骤②的离子方程式___________;简述用pH试纸测定溶液 pH的过程:_____________。
(2)步骤④包括三个操作环节,分别是___________、_____________、_____________。
(3)步骤⑤不直接用水洗的原因是_________________,洗涤的操作是___________。
(4)有人建议:直接将硬铝溶于稀H2SO4中,过滤:滤液中加适量K2SO4得到溶液丙,再进行后续实验。请你评价此建议的可行性_____________。
(1)写出步骤②的离子方程式___________;简述用pH试纸测定溶液 pH的过程:_____________。
(2)步骤④包括三个操作环节,分别是___________、_____________、_____________。
(3)步骤⑤不直接用水洗的原因是_________________,洗涤的操作是___________。
(4)有人建议:直接将硬铝溶于稀H2SO4中,过滤:滤液中加适量K2SO4得到溶液丙,再进行后续实验。请你评价此建议的可行性_____________。
(1)AlO2-+H++H2O=Al(OH)3↓ 或Al(OH)4-+H+=Al(OH)3↓+H2O ;用洁净的玻璃棒沾取溶液滴到pH试纸上,待变色后,与比色卡对照,读出pH
(2)加热浓缩 ;冷却结晶 ;过滤
(3)减少产品的损失(或“减少晶体的溶解”或“明矾 在酒精中的溶解度小”等) ;往漏斗中加入洗涤剂 至浸没固体,自然流出,重复2~3次
(4)不可行 ,因为按此方法获得的溶液中还含有 Mg2+ ,最后得到的产品不纯
(2)加热浓缩 ;冷却结晶 ;过滤
(3)减少产品的损失(或“减少晶体的溶解”或“明矾 在酒精中的溶解度小”等) ;往漏斗中加入洗涤剂 至浸没固体,自然流出,重复2~3次
(4)不可行 ,因为按此方法获得的溶液中还含有 Mg2+ ,最后得到的产品不纯

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


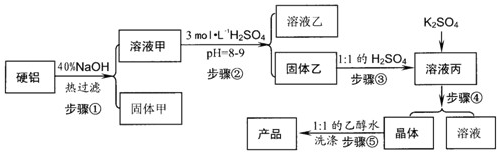
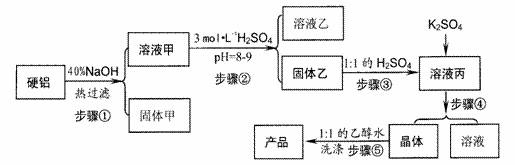
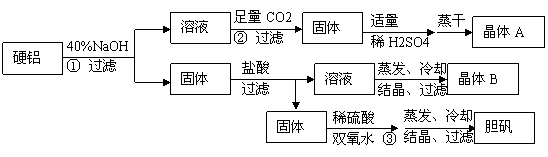 (8分)关于硬铝废料(含90%铝、2.5%镁、7.5%铜)的利用,某探究小组进行了下列实验。
(8分)关于硬铝废料(含90%铝、2.5%镁、7.5%铜)的利用,某探究小组进行了下列实验。