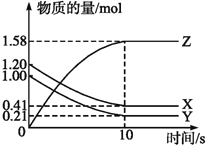
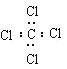题目内容
【题目】草酸氧钛钡晶体[化学式为BaTi(C2O4)2·4H2O]是制造电子陶瓷原料钛酸钡的重要中间体,可通过以下工艺流程制备。
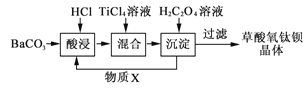
回答下列问题:
(1)酸浸时发生的反应的离子方程式为___;为提高BaCO3的酸浸率,可采取的措施为___(写出一条)。
(2)可循环使用的物质X的电子式为___。
(3)结合流程判断,草酸氧钛钡___(填“能”或“不能”)溶于稀盐酸。
(4)TiCl4(沸点137℃)露置在空气中会迅速与空气中的水反应,有白雾产生,生成的白色二氧化钛粉末用途广泛,写出反应的化学方程式:___。工业上用氯化法制得的粗四氯化钛中常混有SiCl4(沸点57.6℃)、VOCl3(沸点127.2℃),可用___法除去SiCl4;不能用该法除去VOCl3,原因是___。
(5)单质钛是一种性能优异的稀有金属,在军事、航天、医学等领域有广泛用途。以TiCl4和金属镁为原料制取金属钛的化学方程式为___。
【答案】BaCO3+2H+=Ba2++CO2↑+H2O 将碳酸钡矿石粉碎 ![]() 不能 TiCl4+2H2O=TiO2+4HCl↑ 蒸馏 VOCl3与TiCl4的沸点相差太小 TiCl4+2Mg
不能 TiCl4+2H2O=TiO2+4HCl↑ 蒸馏 VOCl3与TiCl4的沸点相差太小 TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
【解析】
碳酸钡与盐酸反应生成氯化钡,然后氯化钡与四氯化碳、草酸反应生成BaTiO(C2O4)2·4H2O,同时得到X为HCl,HCl再循环利用,经过过滤、洗涤、干燥得到草酸氧钛钡晶体。
(1)酸浸时碳酸钡与盐酸反应生成氯化钡、二氧化碳与水,反应离子方程式为:BaCO3+2H+=Ba2++CO2↑+H2O,将碳酸钡矿石粉碎、搅拌等,可提高反应速率,
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;将碳酸钡矿石粉碎;
(2)物质X为HCl,电子式为![]() ,
,
故答案为:![]() ;
;
(3)生成草酸氧钛钡晶体同时也生成HCl,说明草酸氧钛钡不能溶于稀盐酸,
故答案为:不能;
(4)TiCl4露置在空气中会迅速与空气中的水反应,有白雾产生,生成白色的二氧化钛,白雾是由生成的HCl与空气中水蒸气结合形成的小液滴,反应方程式为:TiCl4+2H2O=TiO2+4HCl↑,
由物质的沸点可知,SiCl4与TiCl4的沸点相差比较大,可以用蒸馏的方法除去SiCl4,而VOCl3与TiCl4的沸点相差不大,不能用蒸馏方法除去,
故答案为:TiCl4+2H2O=TiO2+4HCl↑;蒸馏;VOCl3与TiCl4的沸点相差太小;
(5)TiCl4和金属镁发生置换反应生成Ti与MgCl2,反应方程式为:TiCl4+2Mg![]() 2MgCl2+Ti,
2MgCl2+Ti,
故答案为:TiCl4+2Mg![]() 2MgCl2+Ti。
2MgCl2+Ti。

 高效智能课时作业系列答案
高效智能课时作业系列答案【题目】CO和H2被称为合成气,用合成气可以合成乙酸。回答下列问题:
(1)已知CO、H2、CH3COOH的燃烧热分别为-283.0kJ/mol、-285.8kJ/mol、-1255.0kJ/mol,则用合成气合成CH3COOH(l)的可逆过程的热化学反应方程式为______;
(2)在密闭容器中发生合成乙酸的反应,下列可以提高CH3COOH产率的措施有________。
A.恒温恒容,通入少量氦气 B.及时分离出产物乙酸
C.加入高效催化剂 D.压缩容器体积
(3)在150℃时,2L的密闭容器中发生反应:2H2(g)+2CO(g)CH3COOH(g) ΔH>0,起始通入4molH2和4molCO,CH3COOH蒸汽的浓度数据随时间变化如下表所示:
时刻/min | 0 | 2 | 4 | 6 | 8 |
c(CH3COOH)/mol/L | 0 | 0.3 | 0.5 | 0.6 | 0.6 |
①0~2min内用CO表示该反应的速率为______,随着反应的进行速率逐渐减慢的可能原因是________;
②150℃时该反应的平衡常数的数值约为_________;(计算结果保留一位小数)
③平衡后再通入1molH2,则CH3COOH(g)的体积分数________,若再次通入1molH2和1molCO,则CH3COOH(g)的体积分数_________。(填“增大”“减小”或者“不变”)
【题目】某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3 溶液,一段时![]() 间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
(1)查阅资料 知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定。已知第一步反应的离子方程式为IO3—+3HSO3—===3SO42—+I—+3H+,则第二步反应的离子方程式为________________。
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。
编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度 /℃ | 溶液变蓝所用时间t/s |
① | 6.0 | 10.0 | 4.0 | 15 | t1 |
② | 6.0 | 14.0 | 0 | 15 | t2 |
③ | 6.0 | a | b | 25 | t3 |
实验①②是探究_______________对反应速率的影响,表中t1___________t2(填“>”、“=”或“<”);
实验①③是探究温度对反应速率的影响,表中a=_____________,b=_____________。、
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率 逐渐增大。该小组对其原因提出如下假设,请你完成假设二。
假设一:生成的SO42—对反应起催化作用;
假设二:___________________________;……
(4)请你设计实验验证上述假设一,完成下表中内容。
实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 在烧杯乙中先加入少量①_____,其他条件与甲完全相同,用速率检测仪测定起始时的反应速率v(乙) | ②若v(甲)___v(乙),则假设一不成立 ③若v(甲)___v(乙),则假设一成立 (填“>”、“=”或“<”) |