题目内容
8.有一包未知组成的固体粉末,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们,做了如下实验:①将固体混合物溶于水,搅拌后得无色透明溶液;
②往此溶液中滴加BaCl2溶液,有白色沉淀生成;
③过滤,将沉淀物置于足量稀硝酸中,发现沉淀全部溶解.
试判断:
(1)固体混合物中肯定有Na2CO3.
(2)写出实验③中的离子方程式:BaCO3+2H+=Ba2++CO2↑+H2O
(3)设计实验,证明固体粉末中可能有的物质是否存在.简述实验操作,现象和结论.并用离子方程式描述原理.
分析 由①硫酸铜溶液是蓝色的,而白色固体加水得到了无色溶液,故固体中一定不含有CuSO4;由②溶液中滴入BaCl2溶液,有白色沉淀生成沉淀为碳酸钡或硫酸钡;由③过滤,然后在此白色沉淀中加入足量稀硝酸,沉淀最后全部消失,则沉淀为碳酸钡,则原固体一定含Na2CO3,一定不含Na2SO4,因碳酸钠与氯化钙反应生成沉淀,结合①可知,一定不含CaCl2,以此来解答.
解答 解:由①硫酸铜溶液是蓝色的,而白色固体加水得到了无色溶液,故固体中一定不含有CuSO4;由②溶液中滴入BaCl2溶液,有白色沉淀生成沉淀为碳酸钡或硫酸钡;由③过滤,然后在此白色沉淀中加入足量稀硝酸,沉淀最后全部消失,则沉淀为碳酸钡,则原固体一定含Na2CO3,一定不含Na2SO4,因碳酸钠与氯化钙反应生成沉淀,结合①可知,一定不含CaCl2,综上所述,一定含Na2CO3,一定不含Na2SO4、CuSO4、CaCl2,可能含NaCl,
(1)固体混合物中肯定有Na2CO3,故答案为:Na2CO3;
(2)实验③中沉淀是碳酸钡,置于足量稀硝酸中,沉淀全部溶解,离子方程式为:BaCO3+2H+=Ba2++CO2↑+H2O,故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
(3)要确定氯化钠的存在取原固体溶于水需要先加硝酸酸化,再加入AgNO3溶液,生成沉淀则含NaCl,否则不含,
故答案为:取原固体溶于水需要先加硝酸酸化,再加入AgNO3溶液,生成沉淀则含NaCl,否则不含.
点评 本题考查物质检验和鉴别实验方案的设计,为高频考点,把握物质的性质及实验中现象与结论的关系为解答的关键,注意③沉淀完全溶解为解答的突破口,题目难度不大.

练习册系列答案
相关题目
18.下列化学用语正确的是( )
| A. | 次氯酸分子的电子式: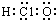 | B. | CH4Si的结构式: | ||
| C. | HCN分子的结构式:H-C≡N | D. | 丙烷分子的比例模型: |
19.在MgCl2、KCl、K2SO4三中盐的混合溶液中,若K+、Cl-、Mg2+的物质的量分别为1.5mol、1.5mol、0.5mol,则SO42-的物质的量为( )
| A. | 0.1mol | B. | 0.15mol | C. | 0.5mol | D. | 0.75mol |
16.将4.6g金属Na投入到足量的不同浓度的下列盐酸(1)0.365%;(2)3.65%;(3)36.5%,则放出H2的物质的量( )
| A. | (3)最少 | B. | (3)最多 | C. | 都一样多 | D. | 无法确定 |
3.下列说法正确的是( )
| A. | 明矾可用于水的消毒、杀菌 | B. | NaHCO3可用于治疗胃酸过多 | ||
| C. | 浓硝酸保存于无色玻璃瓶中 | D. | 氢氟酸可保存于玻璃瓶中 |
13.反应H2(g)+I2(g)?2HI(g)的平衡常数K1;反应2HI(g)?H2(g)+I2(g)的平衡常数K2,则K1、K2的关系为(平衡常数为同温度下的测定值)( )
| A. | K1=-K2 | B. | K1=K2 | C. | K1=$\frac{1}{{K}_{2}}$ | D. | K1=$\frac{1}{2}$K2 |
4.工业上用洗净的废铜作原料来制备硝酸铜.为了节约原料和防止污染环境,宜采取的方法是( )
| A. | Cu$→_{△}^{H_{2}SO_{4}(浓)}$Cu(NO3)2 | B. | Cu$→_{△}^{空气}$CuO$\stackrel{HNO_{3}(稀)}{→}$Cu(NO3)2 | ||
| C. | Cu$\stackrel{HNO_{3}(稀)}{→}$Cu(NO3)2 | D. | Cu$\stackrel{HNO_{3}(浓)}{→}$Cu(NO3)2 |
 、
、 ;
;