题目内容
【题目】锆(Zr)是40号元素,位于第五周期ⅣB族,锆可溶于氢氟酸和王水,锆及其化合物在陶瓷、耐火材料等多个领域有着重要用途。请回答下列相关问题。
(1)基态锆原子的价电子排布图(轨道表示式)是___。
(2)ZrSiO4和ZrSiO3是锆的两种硅酸盐,二者含有的阳离子Zr4+和Zr2+中比较稳定的是____,原因是___。SiO32-的空间构型是____,SiO42-中的Si原子的杂化类型是____。
(3)[Zr(C2H5O)2]2+是Zr4+形成的一种配离子,其中的配位原子是___(填元素符号),该离子中含有的化学键种类不包括___(填选项序号)。
A.极性键 B.非极性键 C.σ键 D.π键
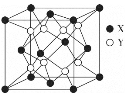
(4)立方氧化锆是一种人工合成的氧化物,由于硬度极高且外观接近钻石常被用作钻石的替代品,其晶胞结构如图所示,立方氧化锆的化学式是___,锆原子的配位数是____。若晶胞中距离最近的两个氧原子间的距离为anm,则立方氧化锆的密度为__g/cm3。
【答案】![]() Zr4+ Zr4+的4d和5s能级均为全空,结构比较稳定 平面三角形 sp3 O D ZrO2 8
Zr4+ Zr4+的4d和5s能级均为全空,结构比较稳定 平面三角形 sp3 O D ZrO2 8 ![]()
【解析】
(1)基态锆原子的价电子排布图(轨道表示式)是![]() ;
;
答案为:![]() ;
;
(2)Zr4+的4d和5s能级均为全空,结构比较稳定,因此Zr4+比Zr2+稳定;根据价层电子理论,SiO32-中心原子价电子对数=![]() ,为sp2杂化,共有4个原子构成,空间构型为平面三角形;SiO42-中的Si原子为中心原子,价电子对数=4,为sp3杂化。
,为sp2杂化,共有4个原子构成,空间构型为平面三角形;SiO42-中的Si原子为中心原子,价电子对数=4,为sp3杂化。
答案为:Zr4+;Zr4+的4d和5s能级均为全空,结构比较稳定;平面三角形;sp3;
(3)配体C2H5O-中只有氧原子含有孤对电子,因此配位原子是O,该离子的结构是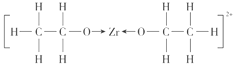 ,其中不含有π键。
,其中不含有π键。
答案为:O;D
(4)根据均摊法可算出晶胞中X原子数目为4,Y原子数目为8,结合锆和氧的常见价态可知其化学式为ZrO2,X为锆原子,其配位数为8。晶胞中距离最近的两个氧原子间的距离为anm,则晶胞棱长为2anm,立方氧化锆的密度![]() 。
。
答案为:ZrO2;8;![]() ;
;

 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案