题目内容
【题目】某工厂排放的工业废水中含Fe3+、Al3+、Cu2+ , 为了减少环境污染,变废为宝,利用废铁屑制得Fe2O3、Al2O3和金属Cu,过程如下.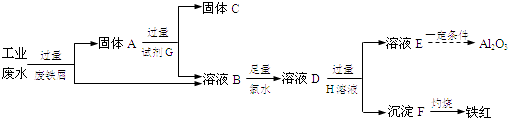
请回答:
(1)固体A的成分是(填化学式).
(2)溶液B中的金属阳离子有 .
(3)B→D反应的离子方程式是 .
(4)试剂G是(填名称).
【答案】
(1)Fe和Cu
(2)Fe3+、Al3+、Fe2+
(3)2Fe2++Cl2=2Fe3++2Cl﹣
(4)盐酸
【解析】解:由流程可知,某工厂排放的工业废水中含Fe3+、Al3+、Cu2+ , 先加过量铁2Fe3++Fe═3Fe2+ , 铁在金属活动顺序表中排在铜的前面,所以铁粉把铜置换出来,发生Fe+Cu2+═Cu+2Fe2+ , 由于铁过量,可知固体A中含Fe和Cu;试剂G为盐酸,Cu与盐酸不反应,则固体C为Cu,溶液B中含Fe3+、Al3+、Fe2+ , 加氯水,+2价的铁离子被氯水氧化,2Fe2++Cl2=2Fe3++2Cl﹣;再加过量D为NaOH,溶液E为偏铝酸钠,沉淀F为Fe(OH)3 , (1)由上述分析可知,A为Fe和Cu,所以答案是:Fe和Cu;(2)溶液B中的金属阳离子有Fe3+、Al3+、Fe2+ , 所以答案是:Fe3+、Al3+、Fe2+;(3)B→D反应的离子方程式是2Fe2++Cl2=2Fe3++2Cl﹣ , 所以答案是:2Fe2++Cl2=2Fe3++2Cl﹣;(4)由上述分析可知,G为盐酸,所以答案是:盐酸.

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案【题目】下列各选项中的两个反应,可用同一个离子方程式表示的是( )
选项 | Ⅰ | Ⅱ |
A | Ba(OH)2溶液与过量NaHCO3溶液混合 | NaOH溶液与过量NaHCO3溶液混合 |
B | 少量SO2通入Ba(OH)2溶液中 | 过量SO2通入Ba(OH)2溶液中 |
C | BaCl2溶液与Na2SO3溶液混合 | Ba(OH)2溶液与H2SO3溶液混合 |
D | 少量NaHCO3溶液滴入澄清石灰水中 | 少量NaOH溶液滴入Ca(HCO3)2溶液中 |
A.A
B.B
C.C
D.D