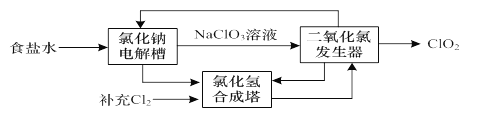
��Ŀ����
����Ŀ���ҹ�����ר�Һ�°Ľ����������������Ƽ����Ϊ�����Ƽҵ������ͻ�����ף�����������ͼ1��

��1������йط�Ӧ�Ļ�ѧ����ʽ
�������أ�NH3+CO2+H2O+NaCl=NaHCO3��+NH4Cl
������¯��
��2�������Ƽ���ŵ�����У�����ȷ����
A������ԭ��Ϊ��ʳ�Ρ�NH3��CO2
B���������Ȼ�刺�������
C�����������п�ѭ�����õ�����ֻ��CO2
D��ԭ�������ʸ�
ijʵ��С�飬��������װ��ͼ2ģ���������Ƽ���ĵ�һ����Ӧ��
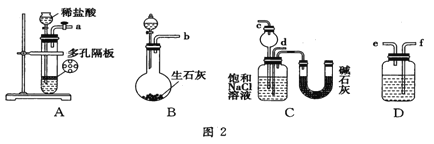
��3������װ���нӿ�����˳��Ϊ ��
A��a��c��b��f��e��d B��a��d��b��f��e��c
C��b��d��a��e��f��c D��b��c��a��f��e��d
��4��D��Ӧѡ�õ�Һ��Ϊ ��
Ϊ�ⶨ��Ʒ����ijɷֺͺ�����������ʵ�飮�����Ʒ������ֻ��NaCl��NaHCO3���ʣ�
��5�������Ʒ�������Ƿ���NaCl����ȡ������������ˮ���ٵμ� �Լ���
��6���ζ����ⶨ�����Ʒ��NaHCO3�����ķ����ǣ�ȷ��ȡ������ƷW g��������ƿ�м�����ˮ�ܽ⣬��1��2�η�ָ̪ʾ������c mol/L��HCl��Һ�ζ�����Һ�ɺ�ɫ��Ϊ��ɫ��ָʾCO32��+H+=HCO3����Ӧ���յ㣩������HCl��Һ���ΪV1mL���ټ�1��2�μ���ָʾ����������HCl��Һ�ζ�����Һ�ɻ�ɫ��Ϊ��ɫ������HCl��Һ�����ΪV2mL������Ʒ��NaHCO3��������Ϊ ��
���𰸡���1��2NaHCO3![]() Na2CO3+CO2��+H2O����2��C����3��D����4������NaHCO3��Һ��
Na2CO3+CO2��+H2O����2��C����3��D����4������NaHCO3��Һ��
��5��ϡHNO3��AgNO3��Һ����6��![]() ��100%��
��100%��
�������������������1��̼���������ȶ��Բ������¯��̼���������ȷֽ�����̼���ơ�CO2��ˮ����Ӧ�Ļ�ѧ����ʽΪ2NaHCO3![]() Na2CO3+CO2��+H2O��
Na2CO3+CO2��+H2O��
��2��A.�������ʳ�Ρ����Ͷ�����̼�����ж�����̼���Ժϳɰ�����ˮú����ȡ����ʱ�ķ�����Ϊԭ������ȡ���A����ȷ��B.�������Ƽ�У��������Ȼ�刺������ʣ�B����ȷ��C�������Ƽѭ�����ʣ��Ȼ��ƣ�������̼��C�����D�������Ƽ����ڰ�����Ȼ��������ʴ�70%��ߵ�90%���ϣ�ԭ�������ʸߣ�D����ȷ����ѡD��
��3��������CO2��NaOH��Ӧ����NaHCO3��װ��A����CO2��װ��B����NH3��װ��D��ȥ������̼�е�HCl��������̼�백��ͨ��C��Ӧ��ֹ��������b��c����a��f��e��d����ѡD��
��4�����������ǿ��̼�ᣬװ��D��ȥ������̼�е�HCl�����ñ���NaHCO3��Һ��
��5��Ҫ�����Ʒ̼�������Ƿ����Ȼ��ƣ�ʵ���Ͼ��Ǽ��������ӵĴ��ڣ����ȵμӹ���ϡ���ᣬ�ų�̼������ӵĸ��ţ��ٵμ���������Һ������а�ɫ�������ɣ����������ӡ�
��6���ӷ�ָ̪ʾ������ɫ��ΧΪ8-10�������ʵ���Ũ��Ϊc��mol/L����HCl��Һ�ζ�����Һ�ɺ�ɫ����ɫ��ָʾCO32-+H+=HCO3-��Ӧ���յ㣬����HCl��Һ���ΪV1mL���ټӼ���ָʾ����������HCl��Һ�ζ�����Һ�ɻƱ�ȣ�ָʾHCO3-+H+=CO2��+H2O��Ӧ���յ㣬����HCl��Һ���ΪV2mL���������������ӷ���ʽΪ��CO32-+H+=HCO3-����HCO3-+H+=CO2��+H2O��������Ʒ�к��е�̼�����Ʒ�Ӧ�����������Ϊ��V2-V1��mL��������������ʵ���Ϊc��V2-V1����1000 mol��̼�����Ƶ����ʵ���Ϊc��V2-V1����1000 mol��̼�����Ƶ�����Ϊc��V2-V1��M��1000 g��̼�����Ƶ���������Ϊ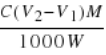 ��100%=
��100%=
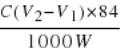 ��100%��
��100%��