【题目】实现“低碳经济”的一项重要课题就是研究如何将CO2转化为可利用的资源。因此,研究CO2 的综合利用对“低碳社会”的构述构建具有重要意义。
(1)一定条件下CO2可以和铁反应:Fe(s)+CO2(g) FeO(s)+CO(g),该反应的平衡常数(K)与温度(T)的关系如图甲所示:
FeO(s)+CO(g),该反应的平衡常数(K)与温度(T)的关系如图甲所示:

①该反应的△H______0(填“<”、“=”或“>”)。
②下列措施,能使平衡时 增大的是______(填序号)。
增大的是______(填序号)。
A.充入一定量的CO B.升高温度 C.使用催化剂
③一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2,反应过程中CO2和CO的物质的量浓度与时间的关系如图乙所示。该反应的平衡常数K=_____________。
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),图丙表示该反应过程中能量的变化。
CH3OH(g)+H2O(g),图丙表示该反应过程中能量的变化。
①下列关于该反应的说法,正确的是______(填序号)。
A.△H<0,△S<0 B.△H>0,△S<0 C.△H>0,△S>0 D.△H<0,△S>0
②已知:CO2(g)+3H2(g) CH3OH(l)+H2O(l) △H=-143.0kJmol-1;
CH3OH(l)+H2O(l) △H=-143.0kJmol-1;
H2(g)+ 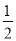 O2(g)=H2O(l) △H=-285.8kJmol-1。
O2(g)=H2O(l) △H=-285.8kJmol-1。
写出表示CH3OH燃烧热的热化学方程式:________________________________。
③一种以甲醇为原料的燃料电池,使用合适的合金为电极,以氢氧化钠溶液、甲醇、氧气为原料,该电池负极的电极反应式为_______________________________。
(3)以CO2为原料还可以合成多种氮肥。
①工业上由CO2和NH3在一定条件下合成尿素的化学方程式为CO2(g)+2NH3(g) CO(NH2)2(l)+H2O(g)。起始以
CO(NH2)2(l)+H2O(g)。起始以 =5投料进行反应,达到化学平衡时CO2的转化率为60%,则NH3的平衡转化率为______________。
=5投料进行反应,达到化学平衡时CO2的转化率为60%,则NH3的平衡转化率为______________。
②将足量CO2通入饱和氨水中可制得碳铵(NH4HCO3)。已知室温下Kb(NH3·H2O)=1.8×10-5,Kal(H2CO3)=4.3×10-7,则 0.lmol/LNH4HCO3 溶液呈_________(填“酸性”“中性”或“碱性”)。
![]() Z(g) + W(s) △H>0,下列叙述正确的是
Z(g) + W(s) △H>0,下列叙述正确的是
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案


