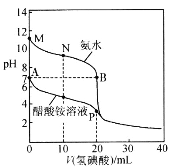
题目内容
【题目】在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g)![]() 2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成xmol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是( )
2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成xmol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是( )
①a、b、c应满足的关系是4a+c=2b
②平衡时HBr为xmol
③a、b、c应满足的关系是a+b=c
④平衡时HBr为![]() xmol
xmol
A.①B.①②C.①④D.②③
【答案】A
【解析】
反应H2(g)+Br2(g) ![]() 2HBr(g)中,反应方程式两边气体的体积不变,压强不影响化学平衡,只要加入的各物质按照化学计量数完全转化成反应物氢气和溴,满足n(A):n(B)=1molH2:2mol=1:2,就属于等效平衡,反应体系中各组分的含量一定相等,据此进行分析。
2HBr(g)中,反应方程式两边气体的体积不变,压强不影响化学平衡,只要加入的各物质按照化学计量数完全转化成反应物氢气和溴,满足n(A):n(B)=1molH2:2mol=1:2,就属于等效平衡,反应体系中各组分的含量一定相等,据此进行分析。
反应H2(g)+Br2(g) ![]() 2HBr(g)中,反应方程式两边气体的体积不变,压强不影响化学平衡,只要加入的各物质按照化学计量数完全转化成反应物氢气和溴,满足n(A):n(B)=1molH2:2mol=1:2,就属于等效平衡,反应体系中各组分的含量一定相等。①a,b,c满足的关系为:4a+c=2b,就满足Br2和H2的物质的量比为2∶1,选项①正确;②达到平衡时HBr的物质的量为xmol,无法确定Br2和H2的物质的量比,选项②错误;③a、b、c满足的关系为a+b=c很难,且无法确定Br2和H2的物质的量比,选项③错误;④该反应两边气体的体积不变,反应后气体的物质的量还是3mol,溴化氢的含量为
2HBr(g)中,反应方程式两边气体的体积不变,压强不影响化学平衡,只要加入的各物质按照化学计量数完全转化成反应物氢气和溴,满足n(A):n(B)=1molH2:2mol=1:2,就属于等效平衡,反应体系中各组分的含量一定相等。①a,b,c满足的关系为:4a+c=2b,就满足Br2和H2的物质的量比为2∶1,选项①正确;②达到平衡时HBr的物质的量为xmol,无法确定Br2和H2的物质的量比,选项②错误;③a、b、c满足的关系为a+b=c很难,且无法确定Br2和H2的物质的量比,选项③错误;④该反应两边气体的体积不变,反应后气体的物质的量还是3mol,溴化氢的含量为![]() ,达到平衡时两个平衡中溴化氢的含量相等,所以达到平衡时HBr物质的量为
,达到平衡时两个平衡中溴化氢的含量相等,所以达到平衡时HBr物质的量为![]() xmol,选项④错误。故选A。
xmol,选项④错误。故选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示:
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 25.00 | 24.41 |
2 | 25.00 | 24.39 |
3 | 25.00 | 24.60 |
回答下列问题:
(1)如图中甲为_________滴定管,乙为_______ 滴定管(填“酸式”或“碱式”)

(2)实验中,不需要润洗的仪器是:________________________
(3)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是________
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果____________(填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果___________。
(5) 未知浓度的NaOH溶液的物质的量浓度为_____________mol/L。