题目内容
四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则下列叙述正确的是( )。
①a-b=n-m ②元素的原子序数:a>b>c>d ③元素非金属性:Z>R ④最高价氧化物对应的水化物的碱性:X>Y
| A.只有③ | B.①②③④ | C.①②③ | D.②③ |
D
解析

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
根据元素周期律和物质结构的有关知识,以下有关排序错误的是( )
| A.离子半径:S2->Cl->Ca2+ | B.原子半径:Ca>S>Cl |
| C.酸性:HClO4<HBrO4<HIO4 | D.热稳定性:HCl>H2S>H2Se |
短周期元素X、Y、Z、W,它们的原子序数依次增大。X与Z同主族,并且原子序数之和为20。Y原子的质子数为Z原子的质子数的一半,W原子的最外层电子数比Y原子的最外层电子数多2个。下列叙述正确的是
| A.原子半径Z>W>Y>X |
| B.Y的最高价氧化物对应的水化物可与其气态氢化物发生化合反应 |
| C.气态氢化物的稳定性Z>W |
| D.X的气态氢化物与足量W单质在光照条件下反应生成物均为气体 |
下列基态原子的电子排布式中,其未成对电子数最多的是( )
| A.1s22s22p63s23p63d54s1 |
| B.1s22s22p63s23p3 |
| C.1s22s22p63s23p63d64s2 |
| D.1s22s22p63s23p63d74s2 |
下列说法错误的是
| A.一定条件下,气体体积大小主要由气体的分子数目决定的 |
| B.有热量变化的过程一定有化学键的断裂与形成 |
| C.通过钠、镁、铝与水反应的实验,可以比较三种单质的金属性强弱 |
| D.轮船外壳连接锌块保护外壳不受腐蚀,是采用了牺牲阳极的阴极保护法 |
下列各组表述中,两个微粒不属于同种元素原子的是( )。
| A.3p能级有一个空轨道的基态原子和核外电子的排布为1s22s22p63s23p2的原子 |
| B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布为2s22p5的原子 |
| C.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p64s2的原子 |
D.最外层电子数是核外电子总数的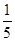 的原子和最外层电子排布为4s24p5的原子 的原子和最外层电子排布为4s24p5的原子 |
n、l、m确定后,仍不能确定该量子数组合所描述的原子轨道的( )。
| A.数目 | B.空间伸展方向 | C.能量高低 | D.电子数目 |
元素周期表是一座开放的“元素大厦”,“元素大厦”尚未客满。若发现119号元素,请在“元素大厦”中安排好它的“房间”( )。
| A.第七周期0族 | B.第六周期第ⅡA族 |
| C.第八周期第ⅠA族 | D.第七周期第ⅦA族 |
金属元素钫(Fr)在自然界中含量极少。它的21个已知同位素都有放射性。它是碱金属元素中最重的元素。根据它在周期表中的位置预言其性质,其中不正确的是( )。
| A.在已知碱金属元素中具有最大的原子半径 |
| B.在空气中燃烧时生成氧化物Fr2O |
| C.氧化物对应的水化物是极强的碱 |
| D.其单质的熔点比金属钠的熔点低 |