题目内容
下列说法错误的是
| A.一定条件下,气体体积大小主要由气体的分子数目决定的 |
| B.有热量变化的过程一定有化学键的断裂与形成 |
| C.通过钠、镁、铝与水反应的实验,可以比较三种单质的金属性强弱 |
| D.轮船外壳连接锌块保护外壳不受腐蚀,是采用了牺牲阳极的阴极保护法 |
B
解析试题分析:A、气体分子间距离比较大,所以一定条件下,气体体积大小主要由气体的分子数目决定,正确;B、分子晶体的状态变化有热量变化,但没有化学键的断裂与形成,错误;C、钠与冷水剧烈反应,镁与热水缓慢反应,铝与水不反应,根据与水反应的剧烈程度,可以比较钠、镁、铝三种金属的金属性强弱,正确;D、轮船外壳连接锌块,锌的活泼性大于铁,锌作原电池的负极,铁作正极受到保护,为牺牲阳极的阴极保护法,正确。
考点:本题考查气体的体积、热量变化与化学键变化、金属性的判断、金属的保护。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则下列叙述正确的是( )。
①a-b=n-m ②元素的原子序数:a>b>c>d ③元素非金属性:Z>R ④最高价氧化物对应的水化物的碱性:X>Y
| A.只有③ | B.①②③④ | C.①②③ | D.②③ |
下列对碱金属性质的叙述中,正确的是( )。
①都是银白色的柔软金属(除铯外),密度都比较小 ②单质在空气中燃烧生成的都是过氧化物 ③碱金属单质都与水剧烈反应 ④单质的熔、沸点随着原子序数的增加而升高
| A.①③ | B.②④ | C.①④ | D.②③ |
下列说法错误的是( )
| A.Na与Al为同周期元素,钠原子最外层有1个电子,铝原子最外层有3个电子,所以钠的金属性比铝强 |
| B.Na与Mg为同周期元素,且Mg的核电荷数比Na的大,所以钠的金属性比镁强 |
| C.NaOH为强碱,而Al(OH)3具有两性,所以钠的金属性比铝强 |
| D.Zn+2Fe3+=Zn2++2Fe2+,所以Zn的金属性比Fe强 |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )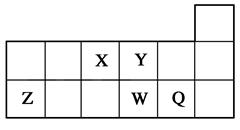
| A.元素X与元素Z的最高正化合价之和的数值等于8 |
| B.原子半径的大小顺序为:rX>rY>rZ>rW>rQ |
| C.离子Y2-和Z3+的核外电子数和电子层数都不相同 |
| D.元素W的最高价氧化物对应的水化物的酸性比Q的强 |
2010年12月3日美国宇航局表示,在地球上发现全新的微生物,它能利用砷代替磷进行新陈代谢,砷含有剧毒。磷一直被认为是生命的6大基本元素,这种细菌的发现或说明可以扩大有机体生存条件及存在可能。下列关于砷和磷两种元素的叙述不正确的是( )
| A.它们的原子最外层电子数相等,元素的最高正化合价都是+5 |
| B.氮的非金属性比砷强,所以NH3的稳定性大于AsH3 |
| C.因为氮的原子半径比砷的小,所以氮的相对原子质量比砷的相对原子质量小 |
| D.它们都是主族元素 |
科学家根据元素周期律和原子结构理论预测,原子序数为114的元素位于第七周期第ⅣA族,称为类铅元素。下面关于它的原子结构和性质的预测正确的是( )
| A.类铅元素原子的最外层电子数为6 |
| B.其常见价态为+2、+3、+4 |
| C.它的金属性比铅强 |
| D.它的原子半径比铅小 |
下列说法肯定错误的是( )
| A.某原子K层上只有一个电子 |
| B.某原子M层上的电子数为L层上电子数的4倍 |
| C.某离子M层上和L层上的电子数均为K层的4倍 |
| D.某离子的核电荷数与最外层电子数相等 |
四种短周期元素W、X、Y、Z的原子序数依次递增,X的一种单质能在空气中自燃。电解含有Y和Z的阴离子的混合溶液时,在阳极Y离子先失去电子。W和Z同主族。对于这四种元素下列判断正确的是( )
| A.气态氢化物的稳定性:W>X>Y>Z |
| B.单质的氧化性:W>Z>Y>X |
| C.四种元素原子半径大小:W<Y<Z<X |
| D.W单质可以将Z从其盐溶液中置换出来 |