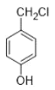
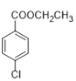
题目内容
【题目】下列关于物质的制备、性质、收集说法正确的是( )
A.汽车尾气中有NOx,主要是汽车打火时氮气和氧气反应引起的
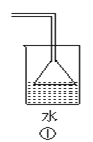
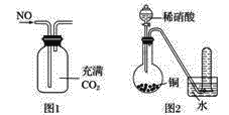
B.可以用图1所示装置收集到干燥的NO气体
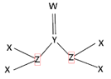
C.根据图2装置收集到的气体为无色能够验证铜和稀硝酸反应的产物中气态物质只有NO
D.可以用湿润的淀粉碘化钾试纸鉴别红棕色气体NO2和溴蒸气
【答案】A
【解析】
A.氮气和氧气在放电条件下生成NO,NO与氧气反应又生成NO2,故A正确;
B.NO的密度比二氧化碳小,所以应该从短管进入,故B错误;
C.如果含有NO2,NO2与水反应会生成硝酸和NO,所以无法排除NO2的干扰,故C错误;
D.溴单质可以将碘离子氧化为碘单质,但是NO2与水反应会生成硝酸,硝酸也可以将碘离子氧化为碘单质,所以,不能用湿润的淀粉碘化钾试纸鉴别红棕色气体NO2和溴蒸气,故D错误。
故选A。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】二氧化碳的回收利用对温室气体的减排具有重要的意义。在2L密闭容器中,加入2.00molCO2和2.0 mol H2以及催化剂发生反应:CO2(g)+H2 (g)![]() HCOOH(g) ΔH,测得,n(H2)/mol在不同温度随时间的变化如下表:
HCOOH(g) ΔH,测得,n(H2)/mol在不同温度随时间的变化如下表:
60 min | 90 min | 120 min | 150 min | 180 min | ||
实验I | Tl/K | 1.50 mol | 1.32 mol | 1.28 mol | 1.26 mol | 1.26 mol |
实验Ⅱ | T2/K | 1.45 mol | 1.20 mol | 1.10 mol | 1.10 mol | 1.10 mol |
(1)比较实验温度T1___T2(填“>”、“<”),该反应的ΔH___0(填“>”、“=”、“<”)。
(2)实验I中0~60 min内用HCOOH表示的该反应的平均反应速率为_____。
(3)实验Ⅱ反应开始时体系压强为P0,第90min时体系压强为Pl,则Pl∶P0=___。
(4)比较实验I、Ⅱ在80min时的逆反应速率大小vl___vⅡ(填“>”、“<”或“无法判断”),原因是_____。