题目内容
某硫酸镁和硫酸铝的混合溶液中,c(Mg2+)=2mol?L-1,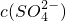 =6.5mol?L-1,若将200mL此混合液中的Mg2+、Al3+分离,至少应加入1.6mol?L-1氢氧化钠溶液的体积是
=6.5mol?L-1,若将200mL此混合液中的Mg2+、Al3+分离,至少应加入1.6mol?L-1氢氧化钠溶液的体积是
- A.0.5L
- B.1.625L
- C.1.8L
- D.2L
D
分析:根据电荷守恒可知,原溶液中2c(Mg2+)+3c(Al3+)=2c(SO42-),据此计算c(Al3+),进而溶液计算n(Al3+).要使原混合液中的Mg2+、Al3+分离,加入的氢氧化钠恰好使Mg2+转化为Mg(OH)2,Al3+转化为Al(OH)3,需要的氢氧化钠的体积最小,此时溶液中溶质为硫酸钠、偏铝酸钠,根据钠元素守恒可知n(Na+)=2n(SO42-)+n(AlO2-),据此计算n(Na+),根据V=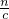 计算氢氧化钠的体积.
计算氢氧化钠的体积.
解答:根据电荷守恒可知,原溶液中2c(Mg2+)+3c(Al3+)=2c(SO42-),所以2×2mol/L+3c(Al3+)=2×6.5mol/L,所以c(Al3+)=3mol/L,
所以原溶液中n(Al3+)=0.2L×3mol/L=0.6mol.
要使原混合液中的Mg2+、Al3+分离,加入的氢氧化钠恰好使Mg2+转化为Mg(OH)2,Al3+转化为Al(OH)3,需要的氢氧化钠的体积最小,
此时溶液中溶质为硫酸钠、偏铝酸钠,
根据钠元素守恒可知n(Na+)=2n(SO42-)+n(AlO2-)=2×0.2L×6.5mol/L+0.6mol=3.2mol,
所以至少应加入1.6mol?L-1氢氧化钠溶液的体积为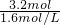 =2L.
=2L.
故选D.
点评:本题考查离子方程式的计算,难度中等,判断加入的氢氧化钠恰好使Mg2+转化为Mg(OH)2,Al3+转化为Al(OH)3,需要的氢氧化钠的体积最小是解题关键,注意计算中守恒的运用.
分析:根据电荷守恒可知,原溶液中2c(Mg2+)+3c(Al3+)=2c(SO42-),据此计算c(Al3+),进而溶液计算n(Al3+).要使原混合液中的Mg2+、Al3+分离,加入的氢氧化钠恰好使Mg2+转化为Mg(OH)2,Al3+转化为Al(OH)3,需要的氢氧化钠的体积最小,此时溶液中溶质为硫酸钠、偏铝酸钠,根据钠元素守恒可知n(Na+)=2n(SO42-)+n(AlO2-),据此计算n(Na+),根据V=
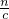 计算氢氧化钠的体积.
计算氢氧化钠的体积.解答:根据电荷守恒可知,原溶液中2c(Mg2+)+3c(Al3+)=2c(SO42-),所以2×2mol/L+3c(Al3+)=2×6.5mol/L,所以c(Al3+)=3mol/L,
所以原溶液中n(Al3+)=0.2L×3mol/L=0.6mol.
要使原混合液中的Mg2+、Al3+分离,加入的氢氧化钠恰好使Mg2+转化为Mg(OH)2,Al3+转化为Al(OH)3,需要的氢氧化钠的体积最小,
此时溶液中溶质为硫酸钠、偏铝酸钠,
根据钠元素守恒可知n(Na+)=2n(SO42-)+n(AlO2-)=2×0.2L×6.5mol/L+0.6mol=3.2mol,
所以至少应加入1.6mol?L-1氢氧化钠溶液的体积为
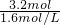 =2L.
=2L.故选D.
点评:本题考查离子方程式的计算,难度中等,判断加入的氢氧化钠恰好使Mg2+转化为Mg(OH)2,Al3+转化为Al(OH)3,需要的氢氧化钠的体积最小是解题关键,注意计算中守恒的运用.

练习册系列答案
相关题目
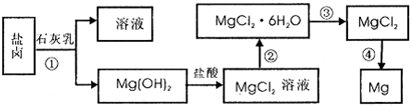
 等)中模拟工业生产来提取镁,主要过程如下,回答下列问题:
等)中模拟工业生产来提取镁,主要过程如下,回答下列问题: