题目内容
(1)产生上述实验现象的试剂组合有(请用字母代号逐一列出,表格各栏可填满,可不填满,也可补充)
| 组别 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 甲 | B | |||||||
| 乙 | D |
(3)如图是某一组实验中所得沉淀的物质的量(n沉淀/mol)随甲溶液中溶质的物质的量(n甲/mol)变化的曲线.符合图(右)曲线的试剂组合是:甲
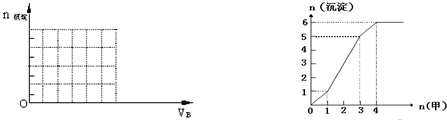
(2)将氢氧化钡溶液逐滴加入明矾溶液中,可能发生的反应有3Ba(OH)2+2KAl(SO4)2=3BaSO4↓+2Al(OH)3↓+K2SO4;2Ba(OH)2+KAl(SO4)2=2BaSO4↓+KAlO2+2H2O,以此作图;
(3)根据沉淀的量先增多,后减少,最后沉淀的量不变进行判断.
| 组别 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 甲 | B | C | B | E | E | D | ||
| 乙 | C | B | E | B | A | B |
| 组别 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 甲 | B | C | B | E | E | D | ||
| 乙 | C | B | E | B | A | B |
| n[Ba(OH)2] |
| n[KAl(SO4)2] |
| 3 |
| 2 |
3Ba(OH)2+2KAl(SO4)2=3BaSO4↓+2Al(OH)3↓+K2SO4;当
| n[Ba(OH)2] |
| n[KAl(SO4)2] |
2Ba(OH)2+KAl(SO4)2=2BaSO4↓+KAlO2+2H2O;产生1 mol Al(OH)3沉淀时需消耗3 mol OH-,溶解1 mol Al(OH)3沉淀时需消耗1 mol OH-,据此作出图象如下:
 ,故答案为:
,故答案为: ;
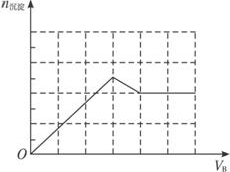
;(3)甲为Ba(OH)2,乙为HNO3和MgSO4的混合溶液时,符合给出的图示关系,原理:将Ba(OH)2溶液逐滴加入HNO3和MgSO4的混合溶液中,开始加入的Ba(OH)2将HNO3中和,产生的沉淀只有BaSO4;等到将HNO3完全被中和后再继续滴加Ba(OH)2溶液,在产生BaSO4沉淀的同时还会产生Mg(OH)2沉淀,图象中线的斜率增大(陡度增大);等到溶液中的 完全沉淀后,再继续滴加Ba(OH)2溶液,只产生Mg(OH)2沉淀,此时图象中直线的斜率变小,当溶液中的Mg2+完全沉淀后,产生的沉淀量保持不变(图象保持水平).
故答案为:Ba(OH)2;HNO3和MgSO4

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案有下列七种溶液:A、氢氧化钠溶液;B、氢氧化钡溶液;C、硫酸铝溶液;D、明矾溶液;E、混有少量硝酸的硫酸镁溶液;F、氯化铁溶液;任取其中的一种溶液(甲)逐滴加入到另一种溶液(乙)中至过量,观察到自始至终均有白色沉淀。试回答下列问题:
(1)产生上述实验现象的试剂组合有(请用字母代号逐一列出,表格各栏可填满,可不填满,也可补充)
| 组别 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 甲 | B |
|
|
|
|
|
|
|
| 乙 | D |
|
|
|
|
|
|
|
(2)请在下列坐标中作出第1组实验所得沉淀的物质的量(n沉淀/mol)随B溶液体积(VB/L)变化的曲线。

(3)右图是某一组实验中所得沉淀的物质的量(n沉淀/mol)随甲溶液中
 溶质的物质的量(n甲/mol)变化的曲线。符合下图曲线的试剂组合
溶质的物质的量(n甲/mol)变化的曲线。符合下图曲线的试剂组合
是:甲 (填化学式)、乙 (填化学式)。
①若实验时取用的乙溶液为500 mL,试计算乙溶液中溶质的物质的
量的浓度。
②若向500 mL乙溶液中滴加1000 mL甲溶液时恰好得到bmol
(1<b<5)白色沉淀,请计算甲溶液中溶质的物质的量浓度。
有下列七种溶液:
| A.氢氧化钠溶液; | B.氢氧化钡溶液; | C.硫酸铝溶液; | D.明矾溶液; |
任取其中的一种溶液(甲)逐滴加入到另一种溶液(乙)中至过量,观察到自始至终均有白色沉淀。试回答下列问题:
(1)产生上述实验现象的试剂组合有(请用字母代号逐一列出,表格各栏可填满,可不填满,也可补充)
| 组别 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 甲 | B | | | | | | | |
| 乙 | D | | | | | | | |
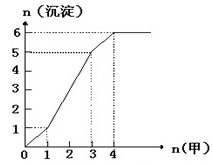
(3)下图是某一组实验中所得沉淀的物质的量(n沉淀/mol)随甲溶液中溶质的物质的量(n甲/mol)变化的曲线。符合下图曲线的试剂组合是:甲 (填化学式);乙 (填化学式)。
若实验时取用的乙溶液为500 mL,试计算乙溶液中溶质的物质的量的浓度
有下列七种溶液:A、氢氧化钠溶液;B、氢氧化钡溶液;C、硫酸铝溶液;D、明矾溶液;E、混有少量硝酸的硫酸镁溶液;F、氯化铁溶液;任取其中的一种溶液(甲)逐滴加入到另一种溶液(乙)中至过量,观察到自始至终均有白色沉淀。试回答下列问题:
(1)产生上述实验现象的试剂组合有(请用字母代号逐一列出,表格各栏可填满,可不填满,也可补充)
|
组别 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
甲 |
B |
|
|
|
|
|
|
|
|
乙 |
D |
|
|
|
|
|
|
|
(2)请在下列坐标中作出第1组实验所得沉淀的物质的量(n沉淀/mol)随B溶液体积(VB/L)变化的曲线。

(3)下图是某一组实验中所得沉淀的物质的量(n沉淀/mol)随甲溶液中溶质的物质的量(n甲/mol)变化的曲线。符合下图曲线的试剂组合是:甲 (填化学式);乙 (填化学式)。

若实验时取用的乙溶液为500 mL,试计算乙溶液中溶质的物质的量的浓度
有下列七种溶液:A、氢氧化钠溶液;B、氢氧化钡溶液;C、硫酸铝溶液;D、明矾溶液;E、混有少量硝酸的硫酸镁溶液;F、氯化铁溶液;任取其中的一种溶液(甲)逐滴加入到另一种溶液(乙)中至过量,观察到自始至终均有白色沉淀。试回答下列问题:
(1)产生上述实验现象的试剂组合有(请用字母代号逐一列出,表格各栏可填满,可不填满,也可补充)
|
组别 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
甲 |
B |
|
|
|
|
|
|
|
|
乙 |
D |
|
|
|
|
|
|
|
(2)请在下列坐标中作出第1组实验所得沉淀的物质的量(n沉淀/mol)随B溶液体积(VB/L)变化的曲线。

(3)右图是某一组实验中所得沉淀的物质的量(n沉淀/mol)随甲溶液中
 溶质的物质的量(n甲/mol)变化的曲线。符合下图曲线的试剂组合
溶质的物质的量(n甲/mol)变化的曲线。符合下图曲线的试剂组合
是:甲 (填化学式)、乙 (填化学式)。
①若实验时取用的乙溶液为500 mL,试计算乙溶液中溶质的物质的
量的浓度。
②若向500 mL乙溶液中滴加1000 mL甲溶液时恰好得到bmol
(1<b<5)白色沉淀,请计算甲溶液中溶质的物质的量浓度。