题目内容
【题目】按要求填空:
(1)某原子含有 6 个质子和 8 个中子,用核素符号表示该原子__________;(用元素符号表示)
(2)写电子式:HClO:____;NH4+:_____;写结构式:CCl4:_____;CS2:_____;
(3)画出钙原子的原子结构示意图:____;画出溴离子的离子结构示意图:____;
(4)用电子式表示氯化钠的形成过程:_________________________
(5)按要求排序:
下列离子半径由大到小的顺序是:S2- ;Al3+ ;Na+ ;F- ;______________
下列物质熔沸点由高到低的顺序是:H2O;Na2O;H2Se;I2 ;______________
【答案】14 C 或 146C 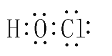
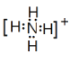
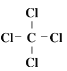 S=C=S 钙原子:
S=C=S 钙原子: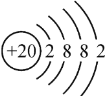 溴离子:
溴离子: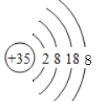
![]() S2- >F- > Na+ >Al3+; Na2O>I2>H2O>H2Se
S2- >F- > Na+ >Al3+; Na2O>I2>H2O>H2Se
【解析】
(1)某原子含有6个质子,说明是C原子,该原子质量数=质子数+中子数=6+8=14,该原子符号为![]() ;
;
(2)HClO是共价化合物,O原子与H、Cl分别形成一个共用电子对,电子式为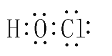 ,铵根中N原子可与3个H原子形成3个共用电子对,N还剩2个未成键电子,可与H+形成配位键,因而铵根电子式为
,铵根中N原子可与3个H原子形成3个共用电子对,N还剩2个未成键电子,可与H+形成配位键,因而铵根电子式为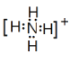 ;CCl4为共价化合物,C原子形成四价,与4个Cl形成单键,因而结构式为
;CCl4为共价化合物,C原子形成四价,与4个Cl形成单键,因而结构式为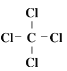 ,CS2中C原子与2个S原子各形成2个共用电子对,因而结构式为S=C=S;
,CS2中C原子与2个S原子各形成2个共用电子对,因而结构式为S=C=S;
(3)钙原子是20号元素,质子数为20,核外电子数为20,且位于第四周期,可推知原子结构示意图为 ,溴离子是35号元素,质子数为35,核外电子数为36,且位于第四周期,可推知离子结构示意图为
,溴离子是35号元素,质子数为35,核外电子数为36,且位于第四周期,可推知离子结构示意图为 ;
;
(4)氯化钠为离子化合物,电子式为![]() ,Na原子和Cl原子电子式分别是
,Na原子和Cl原子电子式分别是![]() 和
和![]() ,因而用电子式表示氯化钠的形成过程为
,因而用电子式表示氯化钠的形成过程为![]() ;
;
(5)S2-核电荷数为16,电子层数为3,Al3+核电荷数为13,电子层数为2,Na+核电荷数为11,电子层数为2,F-核电荷数为9,电子层数为2,首先电子层数越大,半径越大,可知S2-半径大于Al3+、Na+和F-,其次核外电子排布相同的离子,核电荷数越大,半径越小,因而F-半径大于Na+,Na+半径大于Al3+,所以S2->F- > Na+>Al3+;Na2O属于离子晶体,其沸点大于分子晶体H2O、H2span>Se和I2,碘在常温下是固体,沸点较高于H2O和H2Se,另外H2O分子间含有氢键,沸点高于H2Se,因而Na2O>I2>H2O>H2Se。

【题目】根据下表中部分短周期元素的原子半径及主要化合价信息:
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.152 | 0.143 | 0.160 | 0.102 | 0.074 |
主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
请判断以下叙述正确的是( )
A. 氢化物的沸点为H2T<H2R
B. L+与T2-的核外电子数相等
C. 单质L在空气中燃烧生成的氧化物中,氧元素化合价为-1价
D. M与T形成的二元化合物具有两性