题目内容
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A.60 mL | B.45 mL | C.30 mL | D.15 mL |
A
完全生成HNO3,则整个过程中HNO3反应前后没有变化,即Cu失去的电子都被O2得到了,根据得失电子守恒:n(Cu)×2=n(O2)×4
n(Cu)×2="1.68/22.4" mol×4
n(Cu)=0.15mol
所以 Cu(NO3)2 为0.15mol
根据 Cu2+~2OH-
0.15mol n(OH-)
则NaOH 为 0.15mol×2="0.3" mol
则NaOH 体积V=n/c=0.3mol/5mol·L-1
=0.06L,即 60 ml,
选A.
n(Cu)×2="1.68/22.4" mol×4
n(Cu)=0.15mol
所以 Cu(NO3)2 为0.15mol
根据 Cu2+~2OH-
0.15mol n(OH-)
则NaOH 为 0.15mol×2="0.3" mol
则NaOH 体积V=n/c=0.3mol/5mol·L-1
=0.06L,即 60 ml,
选A.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 列4种方法中最好的是________(填“甲”“乙”“丙”或“丁”),理由是______________。
列4种方法中最好的是________(填“甲”“乙”“丙”或“丁”),理由是______________。 3Fe(NO3)3+NO↑+2H2O现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的质量分数为0.20的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积(标准状况下)与剩余固体的质量如下表:
3Fe(NO3)3+NO↑+2H2O现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的质量分数为0.20的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积(标准状况下)与剩余固体的质量如下表: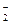 +xI-+yH+=bNO↑+cI2+zH2O,请回答下列问题:
+xI-+yH+=bNO↑+cI2+zH2O,请回答下列问题: 的数值分别是 (全对才给分)。
的数值分别是 (全对才给分)。 。
。