题目内容
【题目】电能是现代社会应用最广泛的能源之一。
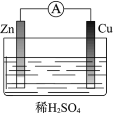
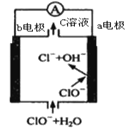
(1)某原电池装置如图所示。其中,Zn电极为原电池的______极(填“正”或“负”),电极反应式是______。Cu电极上发生的反应属于______(填“氧化”或“还原”)反应。电子由______极流出(Zn或Cu),电解质溶液中SO![]() 移向______(Zn或Cu)。
移向______(Zn或Cu)。
(2)下列反应通过原电池装置,可实现化学能直接转化为电能的是______(填序号)。
①CaO+H2O=Ca(OH)2
②2H2+O2 =2H2O
③2FeCl3+Cu=CuCl2+2FeCl2
【答案】负 Zn-2e=Zn2+ 还原 Zn Zn ②③
【解析】
在铜锌原电池中,发生的化学反应是氧化还原反应,锌是还原剂,失去电子被氧化,锌作负极,电子从锌片流出,经导线流向铜,铜作正极,H+在正极上氧化剂得到电子,发生还原反应,内电路中阴离子移向负极、阳离子移向正极,据此回答;
(1)Zn电极为原电池的负极,电极反应式是Zn-2e=Zn2+;Cu电极上发生的反应属于还原反应,电子由Zn极流出,电解质溶液中SO![]() 移向Zn极;
移向Zn极;
答案为:负;Zn-2e=Zn2+;还原;Zn;Zn;
(2)①CaO+H2O=Ca(OH)2是非氧化还原反应,不能设计成原电池,①错误;②2H2+O2 =2H2O可自发发生的氧化还原反应,是放热反应,②正确;③2FeCl3+Cu=CuCl2+2FeCl2是可自发发生的氧化还原反应,是放热反应,③正确;
答案为:②③。

 阅读快车系列答案
阅读快车系列答案【题目】在古代,橘红色的铅丹(Pb3O4)用于入药和炼丹,人们对其中重金属铅的毒性认识不足。已知:PbO2为棕黑色粉末。某化学兴趣小组对铅丹的一些性质进行实验探究并测定其组成。
回答下列问题:
(1)性质实验
实验操作 | 现象 | 解释或结论 |
①将适量铅丹样品放入小烧杯中,加入2mL6mol/L的HNO3溶液,搅拌 | _____ | Pb3O4+4HNO3=PbO2+ 2Pb(NO3)2+2H2O |
②将上述混合物过滤,所得滤渣分为两份,一份加入2mL浓盐酸,加热 | 有刺激性的黄绿色气体产生 | 反应的化学方程式: _______ |
③另一份滤渣加入硝酸酸化的Mn(NO3)2溶液,搅拌 | 得紫色溶液 | 结论:_______ |
(2)组成测定
①准确称取0.530g干燥的铅丹样品,置于洁净的小烧杯中,加入2mL6mol/L的HNO3溶液,搅拌使之充分反应,分离出固体和溶液。该分离操作名称是_____________。
②将①中所得溶液全部转入锥形瓶中,加入指示剂和缓冲溶液,用0.04000mol/L的EDTA溶液(显酸性)滴定至终点,消耗EDTA溶液36.50mL。EDTA与Pb2+的反应可表示为Pb2++H2Y2-=PbY2-+2H+,滴定时EDTA溶液应盛装在_______________中。滤液中含Pb2+__________mol。
③将①中所得固体PbO2全部转入另一锥形瓶中,往其中加入适量HAc与NaAc的混合液和8g固体 KI,摇动锥形瓶,使PbO2全部反应而溶解,发生反应PbO2+4I-+4HAc =PbI2+I2+4Ac-+2H2O,此时溶液呈透明棕色。以0.05000mol/L的Na2S2O3标准溶液滴定,发生反应I2+2S2O32-=S4O62-+2I-,至溶液呈淡黄色时加入2%淀粉溶液1mL,继续滴定至溶液_______,即为终点,用去Na2S2O3溶液30.80mL。
根据②、③实验数据计算,铅丹中Pb(Ⅱ)与Pb(Ⅳ)的原子数之比为____________。