题目内容
【题目】某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设 ①该反应的气体产物是CO2。 ②该反应的气体产物是CO。③该反应的气体产物是______________。
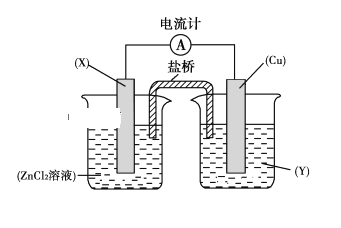
(2)设计方案 如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
(3)查阅资料
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式:_________________________________。
(4)实验步骤

①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为_________________________________。
(5)数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:__________________。
【答案】(8分)
⑴CO2、CO的混合物
⑶NH4++NO2—![]() N2↑+2H2O
N2↑+2H2O
⑷步骤②中是为了排尽空气;步骤④是为了赶出所有的CO2,确保完全吸收
⑸2C+Fe2O3![]() 2Fe+CO↑+CO2↑(各2分)
2Fe+CO↑+CO2↑(各2分)
【解析】
试题(1)结合①②可知③的猜测是该反应的气体产物是CO2、CO的混合物;
(3)氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气的实质是铵根离子与NO2-发生氧化还原反应生成氮气和水,离子方程式为NH4++NO2—![]() N2↑+2H2O
N2↑+2H2O
(4)该反应是氧化铁在隔绝空气的条件下与过量炭粉完全反应,所以开始通入氮气目的是排尽空气;后又通入氮气目的是赶出导气管中的二氧化碳,使产生的二氧化碳气体全部被吸收,减小实验误差;
(5)石灰水中产生的沉淀是碳酸钙沉淀,根据其质量可计算出碳酸钙的物质的量是0.02mol,也即生成二氧化碳的物质的量是0.02mol,质量是0.88g,根据质量守恒定律,生成气体的质量是48.48+3.2+2.0-52.24=1.44g,所以气体产物还有CO,则CO的质量是1.44-0.88=0.56g,物质的量是0.02mol,则碳与氧化铁反应生成二氧化碳、一氧化碳和铁,气体产物的物质的量之比是1:1,所以该实验中氧化铁与碳发生反应的化学方程式2C+Fe2O3![]() 2Fe+CO↑+CO2↑。
2Fe+CO↑+CO2↑。

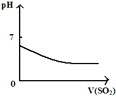
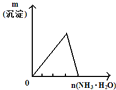
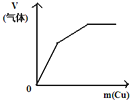
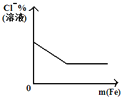
【题目】下列反应中,相关示意图像错误的是
A | B | C | D |
将二氧化硫通入到 一定量氯水中 | 将氨水滴入到一定量氯化铝溶液中 | 将铜粉加入到一定量 浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
|
|
|
|
A. A B. B C. C D. D