题目内容
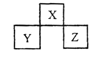
【题目】工业上制得的是熔融态的镁,可以在( )中冷却
A.空气B.氮气C.CO2D.H2
【答案】D
【解析】
气体冷却熔融态的镁单质,则该气体不能与镁发生反应,据此分析。
根据上述分析可知,
A. 镁可在空气中被氧气等氧化,不符合题意,故A不选;
B. 镁可与氮气反应生成氮化镁,不符合题意,故B不选;
C. 镁可与二氧化碳反应生成碳单质与氧化镁,不符合题意,故C不选;
D. 镁与氢气不反应,可在氢气环境下冷却熔融态的镁,符合题意,故D选;
答案选D。

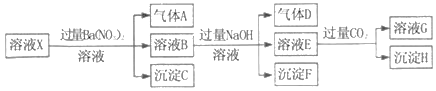
【题目】工业上制备硫酸最重要的一步是SO2的氧化。反应方程式如下: 2SO2(g)+O2(g)![]() 2SO3(g) △H=-196kJ/mol
2SO3(g) △H=-196kJ/mol
回答下列问题:
(1)该反应在________下能自发进行(选填“较高温度”“较低温度”)。
(2)某课外兴趣小组在实验室对该反应进行研究,部分数据如下表。
实验 | 反应条件 | 起始物质的量 | 平衡后性质 | ||||||
催化剂 | 温度(K) | 容积(L) | SO2 | O2 | SO3 | SO2体积分数 | 吸收或放出热量(KJ) | SO2或SO3转化率 | |
① | V2O5 | 770 | 10 | 0.2 | 0.1 | 0 | a1 | Q1 | α1 |
② | V2O5 | 770 | 10 | 0 | 0 | 0.2 | a2 | Q2 | α2 |
③ | V2O5 | 绝热 | 10 | 0 | 0 | 0.2 | a3 | Q3 | α3 |
比较下列数值大小(选填“>”“=”“<”“无法确定”)。
①a1________a2
②Q1+Q2________19.6
③α1+α3 ______ 1
(3) 某同学通过实验绘出如下图像。

t1、t2、t3达到化学平衡状态的是____________
(4)若α1=0.9,计算770K时,正反应的平衡常数为___________。
(5)工业上将SO2转化为SO3时。为了提高反应速率,并有利于SO3的吸收,需要对原料混合气体预热,同时对SO3气体降温。通常采用如图所示的热交换器(中间为空心管道)。下列说法正确的是____________

a.使用热交换器可以充分利用能源
b.A、B、C三处气体的组成相同
c.A、B、C、D四处的气体中均含有SO2
d.预热原料混合气主要是为了提高SO2的平衡转化率