题目内容
【题目】T℃时,在容积为0.5L的密闭容器中发生如下反应。mA(g)+nB(g)![]() pC(g)+qD(s) △H<0(m、n、p、q为最简整数比)。 A、B、C、D的物质的量变化如图所示。
pC(g)+qD(s) △H<0(m、n、p、q为最简整数比)。 A、B、C、D的物质的量变化如图所示。

(1)前3 min,v(C)=_____________。
(2)当下列物理量不再发生变化时,表明该反应已达到平衡状态的是________(填选项字母)。
A.混合气体的压强 B.混合气体的密度
C.混合气体的平均相对分子质暈
D.B的物质的量 E.混合气体的总物质的量
(3)T℃时,该反应的平衡常数K=____________。(小数点后保留2位)
(4)反应达到平衡后,下列措施对A的转化率无影响的是___________(填选项字母)。
A.保持体积不变,再通入2molA和1molB
B.移走一部分D C.把容器的体积缩小一倍 D.升高温度
(5)T℃时,容积为1 L的密闭容器中,起始时充入0.2 mol A、0.4 mol B、0.3 mol C、0.5 molD, 此时v(正)________ (逆)(填“>”、“<”或“=”),判断的依据是____________________________。
【答案】 0.4 mol·L-1·min-1 BCD 1.69 BC = ![]() =
=![]() =1.69=K(或浓度商与平衡常数相等或Qc=K,其他合理答案也给分)
=1.69=K(或浓度商与平衡常数相等或Qc=K,其他合理答案也给分)
【解析】(1)前3 min,v(C)=△c/△t=0.6mol/(0.5L×3min)=0.4 molL-1min-1;(2)根据图中数据知道,A、B、C、D四种物质的物质的量的变化量之比是0.4:0.2:0.6:0.2=2:1:3:1,等于方程式的系数之比,方程式表示为:2A(g)+B(g)3C(g)+D(s),A.反应前后气体的体积不变,所以混合气体的压强不变化,不一定平衡,A错误;B.混合气体的密度等于质量和体积的比值,质量变化,体积不变,所以当密度不变了,达到了平衡,B正确;C.混合气体的平均相对分子质量是质量和物质的量的比值,质量变化,物质的量不变,所以当混合气体的平均相对分子质量不变了,达到了平衡,C正确;D.B的物质的量不变化,是平衡状态的特征,达到了平衡,D正确;E.混合气体的总的物质的量始终是不变化的,E错误,答案选BCD;(3)当达到平衡时,A、B、C的浓度分别是0.8mol/L、1.6mol/L、1.2mol/L,平衡常数K=c3(C)/c2(A)(B)=![]() =1.69;(4)反应2A(g)+B(g)3C(g)+D(s),达到平衡后,A.保持体积不变,通入2mol A和1mol B,会使得A的转化率减小,A错误;B.D是固体,移走一部分D,平衡不移动,A的转化率不变,B正确;C.把容器的体积缩小一倍,即加压,平衡不移动,A的转化率不变,C正确;D.升高温度,平衡逆向移动,A的转化率减小,D错误,答案为选BC;(5)T℃时,容积为1 L的密闭容器中,起始充入0.2mol A、0.4 mol B、0.3 mol C、0.5mol D,此时Qc=c3(C)/c2(A)(B)=
=1.69;(4)反应2A(g)+B(g)3C(g)+D(s),达到平衡后,A.保持体积不变,通入2mol A和1mol B,会使得A的转化率减小,A错误;B.D是固体,移走一部分D,平衡不移动,A的转化率不变,B正确;C.把容器的体积缩小一倍,即加压,平衡不移动,A的转化率不变,C正确;D.升高温度,平衡逆向移动,A的转化率减小,D错误,答案为选BC;(5)T℃时,容积为1 L的密闭容器中,起始充入0.2mol A、0.4 mol B、0.3 mol C、0.5mol D,此时Qc=c3(C)/c2(A)(B)=![]() =1.69=K,仍然是平衡状态,故正逆反应速率相等。
=1.69=K,仍然是平衡状态,故正逆反应速率相等。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】卤族元素在生活中有广泛应用,根据所需知识回答下列问题。
(1)氟元素基态原子的价电子排布图:_________,卤族元素位于元素周期表______区。
(2)在一定浓度的氢氟酸溶液中,部分溶质以二分子缔合(HF)2形式存在,使HF分子缔合的作用力是_______________。
(3)BF3常温下是气体,有强烈的接受弧电子对的倾向。BF3分子的立体构型为______,固态时的晶体类型是_______,BF3与NH3相遇立即生成白色固体,写出该白色固体物质的结构式并标注出其中的配位键_____。
(4)根据下表提供的数据判断,熔点最高、硬度最大的是_______(填化学式)。
离子晶体 | NaF | MgF2 | AlF3 |
晶格能(KJ·mol-1) | 923 | 2957 | 5492 |
(5)已知NaClO2晶体中阴离子为V型,ClO2-中氯原子的弧电子对数是______,ClO2-中氯原子的杂化轨道类型为_____,HClO4比HClO2酸性强的原因是_______。
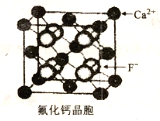
(6)CaF2晶胞如下图所示。已知:NA为阿伏伽德罗常数,棱上相邻的两个Ca2+的核间距为acm,则CaF2的密度可表示为_____g·cm-3。