题目内容
对可逆反应N2(g)+3H2(g) 2NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是
2NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是
 2NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是
2NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是| A.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大 |
| B.若单位时间内消耗x mol N2,同时生成2x mol NH3,则反应达到平衡状态 |
| C.达到平衡后,将容器体积减小为原来的一半,重新达到平衡后,c(NH3)变为原平衡时的2倍 |
| D.若达到平衡时,共放出46.2kJ热量,则有l mo1NH3(g)生成 |
D
升高温度,正、逆反应速率均增大,A错;B中只描述正反应情况,无法判断是否达到平衡,B错;达平衡时,缩小容器体积为原来的一半,由于平衡向正方向移动,所以氨气的物质的量浓度比原一半还要大,C错;由计算关系与放出的热量成比关系知,D正确。

练习册系列答案
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案
相关题目
 2D(g) △H=-QKJ·mol-1。相关条件和数据见下表:
2D(g) △H=-QKJ·mol-1。相关条件和数据见下表: N2O4△H=—56.9kJ/mol下列分析不正确的是
N2O4△H=—56.9kJ/mol下列分析不正确的是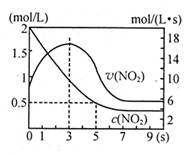
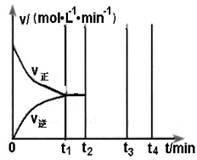
 2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。 2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表:
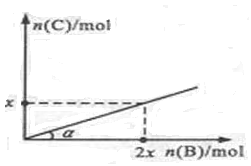
2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表: 2C(g)+ D(g);ΔH<0,在一定温度和压强下达到平衡。若平衡时C的物质的量与加入B的物质的量的变化关系如图所示。 则下列说法中正确的是
2C(g)+ D(g);ΔH<0,在一定温度和压强下达到平衡。若平衡时C的物质的量与加入B的物质的量的变化关系如图所示。 则下列说法中正确的是