题目内容
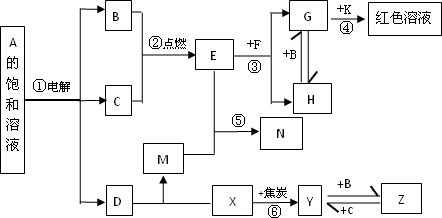
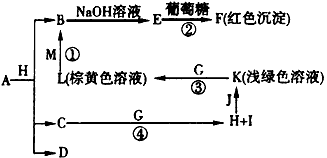
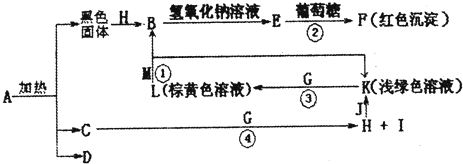
物质A~M有下图所示的转化关系(部分生成物省略).其电C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在元素周期表中X的原子半径最小,Y、Z两原子最外层电子数之和等于10,D为无色非可燃性气体,G为黄绿色气体单质,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板.
请回答下列问题:
(1)比较Y、Z的原子半径大小 > (填元素符号).
(2)写出A的化学式 ,D的电子式 .
(3)K中金属阳离子的检验方法是
(4)反应④中若有2molG单质参加反应,转移电子的数目为
(5)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体,请写出该反应的化学方程式
(6)在高温下6g的Y单质与足量的化合物C反应,吸收QkJ的热量,写出该反应的热化学方程式 .

请回答下列问题:
(1)比较Y、Z的原子半径大小
(2)写出A的化学式
(3)K中金属阳离子的检验方法是
(4)反应④中若有2molG单质参加反应,转移电子的数目为
(5)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体,请写出该反应的化学方程式
(6)在高温下6g的Y单质与足量的化合物C反应,吸收QkJ的热量,写出该反应的热化学方程式
分析:在周期表中X的原子半径最小,X为H,“C(H2O)、D由X(H)、Y、Z中两种元素组成”,则Y、Z中有氧(O),再结合“Y、Z原子最外层电子数之和为10”、“X、Y、Z的原子序数依次增大”,可以确定Z为氧(O)、Y为碳(C);结合转化关系可知,反应②氢氧化铜和葡萄糖的反应,反应①③亚铁离子与铁离子的转化,反应④是氯气与水反应生成两种酸;进而推出D(由H、C、O中的两种元素组成,无色非可燃性气体)为CO2;A分解生成B(CuO)+C(H2O)+D(CO2)可知,A是含有Cu2+的碳酸盐,所以A是CuCO3或Cu2(OH)2CO3;黄绿色气体G为Cl2;浅绿色、棕黄色溶液为Fe2+和Fe3+,则J为Fe,H为HCl,I为HClO,K为FeCl2,L为FeCl3,反应①用于制作印刷电路板为FeCl3和Cu,则M为Cu,E为Cu(OH)2,F为Cu2O,然后结合物质的性质及化学用语来解答.
解答:解:在周期表中X的原子半径最小,X为H,“C(H2O)、D由X(H)、Y、Z中两种元素组成”,则Y、Z中有氧(O),再结合“Y、Z原子最外层电子数之和为10”、“X、Y、Z的原子序数依次增大”,可以确定Z为氧(O)、Y为碳(C);结合转化关系可知,反应②氢氧化铜和葡萄糖的反应,反应①③亚铁离子与铁离子的转化,反应④是氯气与水反应生成两种酸;进而推出D(由H、C、O中的两种元素组成,无色非可燃性气体)为CO2;A分解生成B(CuO)+C(H2O)+D(CO2)可知,A是含有Cu2+的碳酸盐,所以A是Cu2(OH)2CO3;黄绿色气体G为Cl2;浅绿色、棕黄色溶液为Fe2+和Fe3+,则J为Fe,H为HCl,I为HClO,K为FeCl2,L为FeCl3,反应①用于制作印刷电路板为FeCl3和Cu,则M为Cu,E为Cu(OH)2,F为Cu2O,
(1)Y与Z分别是C、O,由同周期原子半径从左向右依次减小可知C、O的原子半径C>O;故答案为:C;O;
(2)由上述分析可知,A是Cu2(OH)2CO3,D的电子式为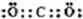 ,故答案为:Cu2(OH)2CO3;
,故答案为:Cu2(OH)2CO3;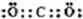 ;
;
(3)K为FeCl2,K中金属阳离子的检验方法是取少量K溶液于试管中,滴加少量硫氰化钾,无血红色,再滴加氯水,溶液变为血红色,则溶液中含Fe2+;或取少量K于试管中,加入NaOH溶液,产生白色沉淀,白色沉淀迅速变为灰绿色,最后转变为红褐色,则溶液中含有Fe2+,
故答案为:取少量K溶液于试管中,滴加少量硫氰化钾,无血红色,再滴加氯水,溶液变为血红色,则溶液中含Fe2+或取少量K于试管中,加入NaOH溶液,产生白色沉淀,白色沉淀迅速变为灰绿色,最后转变为红褐色,则溶液中含有Fe2+;
(4)反应④为Cl2+H2O?HCl+HClO,2molG单质参加反应转移2mol电子,转移电子的数目为2NA或1.204×1024,故答案为:2NA或1.204×1024;
(5)F(Cu2O)+HNO3→Cu(NO3)2(从蓝色可确定为Cu2+)+NO(从无色气体可以确定),由电子守恒及质量守恒定律可知反应的化学方程式为3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O,故答案为:3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O;
(6)高温下6g的Y单质与足量的化合物C反应,吸收QkJ的热量,则1molC(12g)与足量C反应吸收2QkJ的热量,所以热化学方程式为C(s)+H2O(g)=CO(g)+H2(g)△H=+2QkJ/mol,故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+2QkJ/mol.
(1)Y与Z分别是C、O,由同周期原子半径从左向右依次减小可知C、O的原子半径C>O;故答案为:C;O;
(2)由上述分析可知,A是Cu2(OH)2CO3,D的电子式为
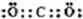 ,故答案为:Cu2(OH)2CO3;
,故答案为:Cu2(OH)2CO3;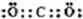 ;
;(3)K为FeCl2,K中金属阳离子的检验方法是取少量K溶液于试管中,滴加少量硫氰化钾,无血红色,再滴加氯水,溶液变为血红色,则溶液中含Fe2+;或取少量K于试管中,加入NaOH溶液,产生白色沉淀,白色沉淀迅速变为灰绿色,最后转变为红褐色,则溶液中含有Fe2+,
故答案为:取少量K溶液于试管中,滴加少量硫氰化钾,无血红色,再滴加氯水,溶液变为血红色,则溶液中含Fe2+或取少量K于试管中,加入NaOH溶液,产生白色沉淀,白色沉淀迅速变为灰绿色,最后转变为红褐色,则溶液中含有Fe2+;
(4)反应④为Cl2+H2O?HCl+HClO,2molG单质参加反应转移2mol电子,转移电子的数目为2NA或1.204×1024,故答案为:2NA或1.204×1024;
(5)F(Cu2O)+HNO3→Cu(NO3)2(从蓝色可确定为Cu2+)+NO(从无色气体可以确定),由电子守恒及质量守恒定律可知反应的化学方程式为3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O,故答案为:3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O;
(6)高温下6g的Y单质与足量的化合物C反应,吸收QkJ的热量,则1molC(12g)与足量C反应吸收2QkJ的热量,所以热化学方程式为C(s)+H2O(g)=CO(g)+H2(g)△H=+2QkJ/mol,故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+2QkJ/mol.
点评:本题综合考查无机框图物质的推断,考查了化学用语、离子检验、物质的性质及热化学方程式等知识点.该题主要以金属Cu、Fe、Cl2及化合物知识为载体考查物质之间的转化及物质推断,仔细斟酌不难发现Cu2O与稀硝酸反应方程式的书写,有机物知识的渗透,并不是简单寻找与合并的过程,而是实现知识迁移,考查学生发散能力的过程,题目难度较大.

练习册系列答案
相关题目

 Al(OH)3+3H+
Al(OH)3+3H+