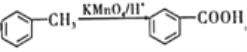题目内容
【题目】如图是利用阴离子交换膜和过滤膜制备高纯度的Cu的装置示意图,下列有关叙述不正确的是
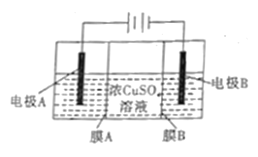
A. 电极A是粗铜,电极B是纯铜
B. 电路中通过1mol电子,生成32g铜
C. 溶液中SO42-向电极A迁移
D. 膜B是过滤膜,阻止阳极泥及杂质进入阴极区
【答案】D
【解析】
电极A连接电源的正极,即电极A为阳极,电极B连接电源的负极,即电极B为阴极,精炼铜时,粗铜为阳极,纯铜为阴极,据此分析;
A、精炼铜时,粗铜作阳极,纯铜作阴极,根据电解原理,电极A为粗铜,电极B为纯铜,故A说法正确;
B、阴极反应式为Cu2++2e-=Cu,当电路中通过1mol电子时,生成0.5molCu,即生成32gCu,故B说法正确;
C、根据电解的原理,SO42-向阳极移动,故C说法正确;
D、膜A为过滤膜,阻止阳极泥及杂质进入阴极区,膜B为阴离子交换膜,可阻止杂质离子阳离子进入阴极区,故D说法错误;
答案选D。

练习册系列答案
相关题目