题目内容
固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用如图装置(夹持装置略)对其进行探究实验。

(1)仪器B的名称是 。
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为__________________;Ⅳ发生反应的化学方程式为 ;Ⅴ中的试剂为____________________。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ→Ⅲ→Ⅳ→Ⅱ→Ⅴ→Ⅵ,此时Ⅱ 中现象为 ,原因是 。
(4)经上述反应,2.5g 化合物A理论上可得0.56L(标准状况)M;则A的化学式为________________。

(1)仪器B的名称是 。
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为__________________;Ⅳ发生反应的化学方程式为 ;Ⅴ中的试剂为____________________。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ→Ⅲ→Ⅳ→Ⅱ→Ⅴ→Ⅵ,此时Ⅱ 中现象为 ,原因是 。
(4)经上述反应,2.5g 化合物A理论上可得0.56L(标准状况)M;则A的化学式为________________。
(1)分液漏斗
(2)碱石灰(或氧化钙) 3CuO+2NH3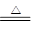 3Cu+N2+3H2O(2分)浓H2SO4
3Cu+N2+3H2O(2分)浓H2SO4
(3)试纸变蓝 CuO与氨气反应生成的水和未反应的氨气形成氨水,使试纸变蓝
(4)Mg3N2
(2)碱石灰(或氧化钙) 3CuO+2NH3
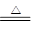 3Cu+N2+3H2O(2分)浓H2SO4
3Cu+N2+3H2O(2分)浓H2SO4(3)试纸变蓝 CuO与氨气反应生成的水和未反应的氨气形成氨水,使试纸变蓝
(4)Mg3N2
(1)根据B的结构特点可知,B是分液漏斗。
(2)Ⅱ中的试纸变蓝,说明反应中有氨气生成。氨气具有还原性,能还原氧化铜。但在和氧化铜反应之前,需要干燥氨气,所以Ⅲ中的试剂为碱石灰,和氧化铜反应的方程式为3CuO+2NH3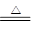 3Cu+N2+3H2O。由于氨气是过量的,所以需要用浓硫酸吸收剩余的氨气,即中的试剂为浓硫酸。
3Cu+N2+3H2O。由于氨气是过量的,所以需要用浓硫酸吸收剩余的氨气,即中的试剂为浓硫酸。
(3)氨气和氧化铜反应氨气一定有剩余的,同时反应中有水生成,所以试纸变蓝。
(4)M是氮气,物质的量是0.025mol,则化合物中氮原子的质量是0.7g,所以另一种元素的质量是1.8g。能和水发生复分解反应的氮的化合物是氮化镁,经验证镁的质量恰好是1.8g,所以化合物是Mg3N2。
(2)Ⅱ中的试纸变蓝,说明反应中有氨气生成。氨气具有还原性,能还原氧化铜。但在和氧化铜反应之前,需要干燥氨气,所以Ⅲ中的试剂为碱石灰,和氧化铜反应的方程式为3CuO+2NH3
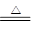 3Cu+N2+3H2O。由于氨气是过量的,所以需要用浓硫酸吸收剩余的氨气,即中的试剂为浓硫酸。
3Cu+N2+3H2O。由于氨气是过量的,所以需要用浓硫酸吸收剩余的氨气,即中的试剂为浓硫酸。(3)氨气和氧化铜反应氨气一定有剩余的,同时反应中有水生成,所以试纸变蓝。
(4)M是氮气,物质的量是0.025mol,则化合物中氮原子的质量是0.7g,所以另一种元素的质量是1.8g。能和水发生复分解反应的氮的化合物是氮化镁,经验证镁的质量恰好是1.8g,所以化合物是Mg3N2。

练习册系列答案
相关题目


