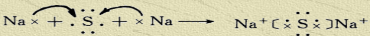题目内容
有A、B、C三种短周期元素,已知A元素的原子最外层电子数等于其电子层数,B元素的原子最外层电子数是其电子层数的2倍,C元素的原子最外层电子数是其电子层 数的3倍.由这三种元素组成的化合物的化学式不可能是( )
| A.A3BC4 | B.A2(BC4)3 | C.A2BC3 | D.A2BC4 |
有A、B、C三种短周期元素,所以其原子序数不大于18,;已知A元素的原子最外层电子数等于其电子层数,所以A可能是H元素、Be元素、Al元素;B元素的原子最外层电子数是其电子层数的2倍,所以B可能是He元素、C元素、S元素;C元素的原子最外层电子数是其电子层数的3倍,所以C是O元素.
ABC三种元素形成的化合物可能是含氧酸或含氧酸盐.
A、如果形成的是含氧酸或含氧酸盐,化合物中各元素的化合价代数和为0,但化合物A3BC4中各元素的化合价代数和不为0,故A错误.
B、如果形成的是含氧酸或含氧酸盐,硫酸铝符合该化学式A2(BC4)3,故B正确.
C、如果形成的是含氧酸或含氧酸盐,碳酸或亚硫酸符合该化学式A2BC3,故C正确.
D、如果形成的是含氧酸或含氧酸盐,硫酸符合该化学式A2BC4,故D正确.
故选A.
ABC三种元素形成的化合物可能是含氧酸或含氧酸盐.
A、如果形成的是含氧酸或含氧酸盐,化合物中各元素的化合价代数和为0,但化合物A3BC4中各元素的化合价代数和不为0,故A错误.
B、如果形成的是含氧酸或含氧酸盐,硫酸铝符合该化学式A2(BC4)3,故B正确.
C、如果形成的是含氧酸或含氧酸盐,碳酸或亚硫酸符合该化学式A2BC3,故C正确.
D、如果形成的是含氧酸或含氧酸盐,硫酸符合该化学式A2BC4,故D正确.
故选A.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等.则下列说法正确的是( )
| A、B与A只能组成BA3化合物 | B、粒子半径D+>C2- | C、A、B、C三种元素可以形成离子化合物 | D、E的氧化物对应的水化物一定有强的氧化性 |
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的族序数与周期数的差为4,且不与A元素在同一周期 |
| E位于周期表中第七列 |
| F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
(1)A的基态原子最外层有 种不同运动状态的电子,F位于 区。
(2)E2+的基态核外电子排布式为 ,AD4为 (填极性或非极性)分子。
(3)A、B、C三种元素的电负性由小到大的顺序是 (用元素符号表示),B和C两元素中,B的第一电离能较大的原因是 ,与AC2互为等电子体的分子的名称为 。(只写一种)
(4)BD3 中心原子的杂化方式为 ,其分子空间构型为 。
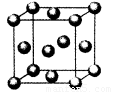
(5)用晶体的x射线衍射法对F的测定得到以下结果:F的晶胞为
面心立方最密堆积(如右图),又知该晶体的密度为ρg/cm3,
晶胞中该原子的配位数为 ;F的原子半径是 pm;
(阿伏加德罗常数为NA)。

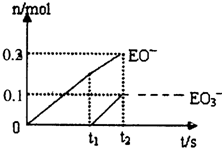 (2011?丹东模拟)有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
(2011?丹东模拟)有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表: