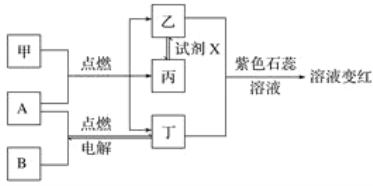
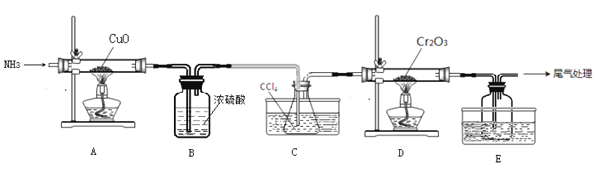
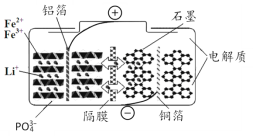
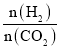题目内容
【题目】下列有关说法中正确的是( )
A.已知常温下0.1mol/LNaHSO3溶液pH<7,则HSO3-电离程度小于水解程度
B.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中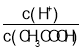 减小
减小
C.已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12。向含有Cl-、CrO42-且浓度均为0.010mol·L-1溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,CrO42-先产生沉淀
D.25℃时,0.1mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
【答案】D
【解析】
A.常温下0.1mol/LNaHSO3溶液pH<7,HSO3-电离程度大于水解程度,A选项错误;
B.向0.1molL-1CH3COOH溶液中加入少量水,醋酸的电离平衡正向移动,则c(H+)减小的程度比c(CH3COOH)小,溶液中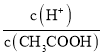 增大,B选项错误;
增大,B选项错误;
C.析出沉淀时,AgCl溶液中c(Ag+)=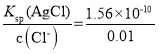 mol/L=1.56×10-8mol/L,Ag2CrO4溶液中c(Ag+)=
mol/L=1.56×10-8mol/L,Ag2CrO4溶液中c(Ag+)=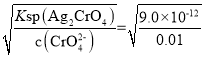 mol/L=3×10-5,c(Ag+)越小,则越先生成沉淀,所以2种阴离子产生沉淀的先后顺序为Cl-、CrO42-,C选项错误;
mol/L=3×10-5,c(Ag+)越小,则越先生成沉淀,所以2种阴离子产生沉淀的先后顺序为Cl-、CrO42-,C选项错误;
D.硫化氢为弱电解质,部分电离,而硫化钠为强电解质,等浓度溶液中硫化氢溶液中离子浓度远远小于硫化钠溶液中离子浓度,硫化氢溶液比等浓度的硫化钠溶液的导电能力弱,D选项正确;
答案选D。

【题目】已知常温下浓度为0.1mol/L的几种溶液的pH如右下表。下列有关说法正确的是( )
溶质 | pH |
NaF | 7.5 |
Na2CO3 | 11.6 |
NaClO | 9.7 |
NaHCO3 | 8.3 |
A. 同温度同浓度下,酸由强到弱的顺序为:HF>H2CO3>HClO
B. 水解方程式:F-+H2O![]() HF+OH-的平衡常数为1×10-13
HF+OH-的平衡常数为1×10-13
C. 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L
D. 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(HF)>c(Na+)>c(F-)>c (H+)>c(OH-)