题目内容
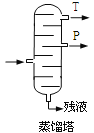
【题目】某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。下列说法不正确的是
A.Zn为电池的负极,发生氧化反应
B.电池工作时OH-向负极迁移
C.该电池放电过程中电解质溶液浓度增大
D.正极反应式为:2FeO42-+10H++6e-=Fe2O3+5H2O
【答案】D
【解析】
A. 电池工作时,Zn失电子是电池的负极、发生氧化反应,A项正确;
B. 负极Zn失电子带正电,吸引溶液中阴离子,故![]() 向负极迁移,B项正确;
向负极迁移,B项正确;
C. 该电池放电过程中,负极Zn→Zn(OH)2,正极K2FeO4→KOH+Fe2O3,总反应为3Zn+2K2FeO4+5H2O=3Zn(OH)2+4KOH+Fe2O3,KOH溶液浓度增大,C项正确。
D. 碱性溶液中,电极反应式不应出现H+,D项错误。
本题选D。

练习册系列答案
相关题目
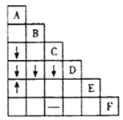
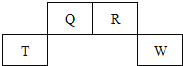
【题目】下表是周期表的一部分,根据A~I在周期表中的位置,回答以下问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | J | F | H | I |
(1)表中元素,化学性质最不活泼的是___________(用元素符号表示,本小题下同);除稀有气体外,原子半径最大的是___________,可用于制半导体材料的元素是_______;形成化合物中种类最多的元素是___________。
(2)最高价氧化物的水化物酸性最强的是___________(填化学式),A分别与D、E、F、G、H形成的化合物中,最稳定的是___________(填化学式)
(3)元素E和元素H的氢化物均极易溶于水,用两根玻璃棒分别醮取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式___________
(4)B、C两元素的最高价氧化物对应水化物之间反应的离子方程式是___________