题目内容
(2013?广州三模)根据下表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述正确的是( )
|
分析:元素的最高正价=最外层电子数,最高正价和最低负价绝对值的和为8,D、E两元素最外层电子数为6,故为第ⅥA元素,而D的半径大于E,故在周期表中E元素在上面,D在下面,故E为O,D为S,B元素最最外层电子数为3,为B或Al,但是半径比氧和硫均大,故位于氧元素和硫元素的中间,应为Al,A的半径比铝大,最外层电子数为1,应为Na,C的半径最小,最外层两个电子,故为Be,结合元素周期律的递变规律解答该题.
解答:解:元素的最高正价=最外层电子数,最高正价和最低负价绝对值的和为8,D、E两元素最外层电子数为6,故为第ⅥA元素,而D的半径大于E,故在周期表中E元素在上面,D在下面,故E为O,D为S,B元素最最外层电子数为3,为B或Al,但是半径比氧和硫均大,故位于氧元素和硫元素的中间,应为Al,A的半径比铝大,最外层电子数为1,应为Na,C的半径最小,最外层两个电子,故为Be,则
A.A、C最高价氧化物对应水化物分别为NaOH和Be(OH)2,其Be(OH)2碱性弱于氢氧化铝,而氢氧化钠的碱性强于氢氧化铝,故碱性NaOH>Be(OH)2,故A正确;
B.H2O含有氢键,分子间作用力较强,氢化物的沸点较高,故B正确;
C.金属钠的活泼性强于铝,故与稀盐酸反应的速率Na>Al,故C错误;
D.Be2+与Na+的核外电子数分别为2、10,二者核外电子数不等,故D错误.
故选AB.
A.A、C最高价氧化物对应水化物分别为NaOH和Be(OH)2,其Be(OH)2碱性弱于氢氧化铝,而氢氧化钠的碱性强于氢氧化铝,故碱性NaOH>Be(OH)2,故A正确;
B.H2O含有氢键,分子间作用力较强,氢化物的沸点较高,故B正确;
C.金属钠的活泼性强于铝,故与稀盐酸反应的速率Na>Al,故C错误;
D.Be2+与Na+的核外电子数分别为2、10,二者核外电子数不等,故D错误.
故选AB.
点评:本题主要考查了学生有关元素周期表的应用知识,题目难度不大,本题关键是能够把握元素的原子半径和化合价的关系,要熟记元素周期表中的递变规律,学以致用.

练习册系列答案
相关题目
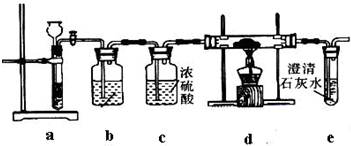

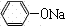 +CO2+H2O→
+CO2+H2O→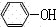 +NaHCO3
+NaHCO3